
【题目】能源是人类生存和发展的重要支柱。研究和有效地开发新能源有重要意义。已知 CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的燃烧过程如图所示:
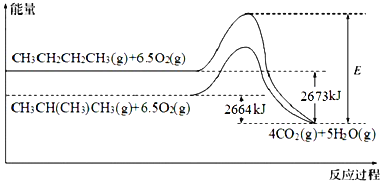
已知:H2O(g)=H2O(l) ΔH=-41kJ·mol-1。请根据以上信息,回答下列有关问题:
(1)图形中 E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的_____。
(2)CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的热稳定性_____更高。
(3)表示CH3CH(CH3)CH3(g)燃烧热的热化学方程式为_____。
(4)CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式为_____
(5)如表所示是部分化学键的键能参数(已知CO的结构式为C≡O):
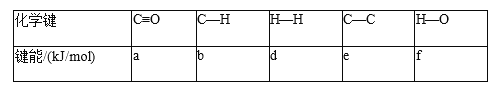
合成气(CO 和 H2 的混合气体)可以合成 CH3CH2CH2CH3(g),同时生成 H2O(g),则合成 1molCH3CH2CH2CH3(g)的 ΔH=__。
【答案】活化能 CH3CH(CH3)CH3 CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)ΔH =-2869kJ·mol-1 CH3CH2CH2CH3(g)→CH3CH(CH3)CH3(g) ΔH =-9kJ·mol-1 [(4a+9d)-(3e+10b+8f)]kJ·mol-1
【解析】
(1)E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的活化能;
(2)物质的能量越低越稳定;
(3)燃烧热是指可燃物完全燃烧生成稳定氧化物放出的热量,结合盖斯定律分析书写;
(4)根据图像有①CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g)△H=-2673kJmol-1,②CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g)△H=-2664kJmol-1,根据盖斯定律分析书写CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式;
(5)根据反应的焓变△H=反应物键能总和-生成物键能总和计算。
(1)图形中 E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的活化能,故答案为:活化能;
(2)根据图象可知,CH3CH2CH2CH3(g)的能量比CH3CH(CH3)CH3(g)高,则CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的热稳定性:CH3CH(CH3)CH3>CH3CH2CH2CH3,故答案为:CH3CH(CH3)CH3;
(3)根据图像有①CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g)△H=-2664kJmol-1,②H2O(g)=H2O(l)△H=-41kJmol-1,根据盖斯定律,将①+②×5得到表示 CH3CH(CH3)CH3(g)燃烧热的热化学方程式为:CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJmol-1,故答案为:CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJmol-1;
(4)根据图像有①CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g) △H=-2673kJmol-1,②CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g) △H=-2664kJmol-1,根据盖斯定律,将①-②得到CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式为:CH3CH2CH2CH3(g)→CH3CH(CH3)CH3(g) △H=-9kJmol-1,故答案为:CH3CH2CH2CH3(g)→CH3CH(CH3)CH3(g) △H=-9kJmol-1;
(5)合成气(CO 和 H2的混合气体)可以合成 CH3CH2CH2CH3(g),同时生成 H2O(g),化学方程式为:4CO(g)+9H2(g)→CH3CH2CH2CH3(g)+4H2O(g),反应的焓变△H=反应物键能总和-生成物键能总和,则合成 1molCH3CH2CH2CH3(g)的△H=[(4a+9d)-(3e+10b+8f)]kJmol-1,故答案为:[(4a+9d)-(3e+10b+8f)]kJmol-1。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物叙述中不正确的是( )
A.氧化镁和氧化铝熔点均很高,常用作耐高温材料
B.在酒精灯加热条件下,![]() 和
和![]() 固体都能分解
固体都能分解
C.二氧化氯具有氧化性,可用于自来水杀菌消毒
D.电闪雷鸣的雨天,![]() 与
与![]() 会发生反应并最终转化为硝酸盐被植物吸收
会发生反应并最终转化为硝酸盐被植物吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
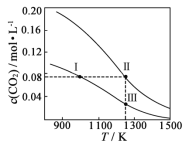
A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )
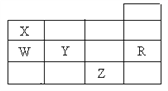
A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知:Y为地壳中含量最多的元素,M原子的最外层电子数与次外层电数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
(1)M在元素周期表中的位置__;Z+离子的结构示意图为__。
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式__。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__。
(4)实验室制备R的单质,该反应的离子方程式为__。
(5)R非金属性强于M,下列选项中能证明这一事实的是__(填字母序号)。
A.常温下的R单质熔沸点比M单质的高
B.R的氢化物比M的氢化物更稳定
C.一定条件下R和M的单质都能与NaOH溶液反应
D.最高价氧化物对应水化物的酸性强弱:R>M
(6)由X、Y、Z、M四种元素组成的一种弱酸酸式盐A。向A溶液中通入氯气,得到无色溶液,写出该反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图有机物分子中带“![]() ”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是
”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是
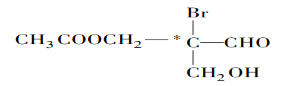
A.与乙酸发生酯化反应B.与NaOH水溶液反应
C.与银氨溶液作用只发生银镜反应D.催化剂作用下与![]() 反应
反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对SCN-的性质进行探究,设计了以下实验
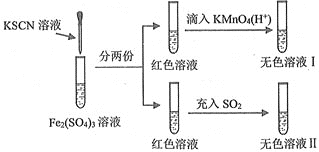
已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( )
A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.红色溶液褪色表现了SO2的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为 ________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为_______。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为__________。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于___________________________。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO] 的酸性由强到弱的顺序为_________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com