
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为 ________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为_______。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为__________。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于___________________________。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO] 的酸性由强到弱的顺序为_________(填序号)。
【答案】[Ar]3d104s24p5 BrI> ICl> Cl2 RbCl V形 HF分子间形成氢键 ①②③
【解析】
(1)根据溴的原子的质子数为35,由能量最低原理来书写电子排布式;
(2)根据相对分子质量来判断范德华力,再比较物质的沸点;
(3)利用F的电负性及氢键来解释;
(4)根据价层电子对结构模型来分析I3+的空间构型;
(5)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,利用半径来分析晶格能相对较大的卤化物;
(6)非金属性越强,则对应最高价含氧酸的酸性就强,同种元素的含氧酸,利用非羟基氧个数来判断酸性。
(1)溴的原子的质子数为35,核外电子数为35,由能量最低原理其电子排布式为[Ar]3d104s24p5,故答案为:[Ar]3d104s24p5;
(2)因相对分子质量BrI>ICl>Cl2,则范德华力BrI>ICl>Cl2,即沸点BrI>ICl>Cl2,故答案为:BrI>ICl>Cl2;
(3)因F的电负性最大,则HF分子中存在氢键则形成二聚分子,故答案为:HF分子间形成氢键;
(4)因I3+可看成II2+,孤电子对数由![]() (a-xb)=
(a-xb)=![]() (7-1-2×1)=2,σ键数为2,则I3+的空间构型为V形,故答案为:V形;
(7-1-2×1)=2,σ键数为2,则I3+的空间构型为V形,故答案为:V形;
(5)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,
则A为RbCl,故答案为:RbCl;
(6)因非金属性Cl>Br>I,非金属性越强,则对应的最高价氧化物的酸性越强,则①的酸性最强,在②③中都是碘元素的含氧酸,非羟基氧个数越多,酸性越强,则酸性到为②>③,故答案为:①②③。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究和有效地开发新能源有重要意义。已知 CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的燃烧过程如图所示:
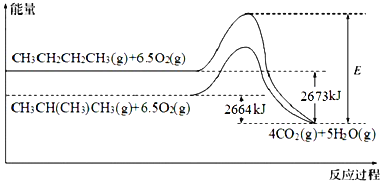
已知:H2O(g)=H2O(l) ΔH=-41kJ·mol-1。请根据以上信息,回答下列有关问题:
(1)图形中 E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的_____。
(2)CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的热稳定性_____更高。
(3)表示CH3CH(CH3)CH3(g)燃烧热的热化学方程式为_____。
(4)CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式为_____
(5)如表所示是部分化学键的键能参数(已知CO的结构式为C≡O):
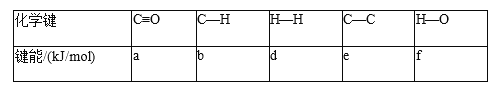
合成气(CO 和 H2 的混合气体)可以合成 CH3CH2CH2CH3(g),同时生成 H2O(g),则合成 1molCH3CH2CH2CH3(g)的 ΔH=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、制取氨气并完成喷泉实验(图中夹持装置均已略去)。
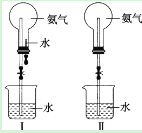
(1)写出实验室制取氨气的化学方程式______。
(2)收集氨气应使用______法,要得到干燥的氨气可选用作干燥剂______。
(3)如果只提供如图Ⅱ所示装置,请说明引发喷泉的方法是______。
Ⅱ.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
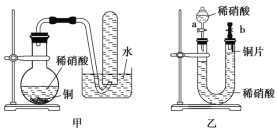
(1)写出铜和稀硝酸反应的离子方程式:______。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是 NO 气体______(填“能”或“不能”),请简述理由(用文字和化学方程式表示):______。
(3)若用实验装置乙进行实验,检查装置气密性的操作是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中的一定量混合气体发生反应:xA(g) + yB(g)![]() zC(g),达到平衡后,测得A的浓度为0.5mol/L,保持温度不变,将容器体积变为原来的两倍,当达到新的平衡时,测得A的浓度为0.23mol/L,则下列叙述错误的是 ( )
zC(g),达到平衡后,测得A的浓度为0.5mol/L,保持温度不变,将容器体积变为原来的两倍,当达到新的平衡时,测得A的浓度为0.23mol/L,则下列叙述错误的是 ( )
A.平衡向正反应方向移动了B.物质C的质量分数增大了
C.物质A的转化率减小了D.x+y<z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近。已知(CN)2分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为__。(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__。
(2)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮可由NO和O2生成,已知在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g) ΔH, n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)该反应的化学平衡常数表达式为K=___________________
(2)已知:K800 ℃>K1 000 ℃,则该反应的ΔH_________0(填“大于”或“小于”),
(3)用O2表示0~2 s内该反应的平均速率为_________。
(4)能说明该反应已达到平衡状态的是_________。
a.容器内气体颜色保持不变 b.2υ逆(NO)=υ正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(5)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有____。
A.升温 B.加入氧气 C. 降温 D.增大压强
(6)在800 ℃时,计算通入2 mol NO和1 mol O2的平衡常数K=_________
(7)已知下列反应在某温度下的平衡常数以及ΔH
H2(g)+S(s) H2S(g) K1 ΔH1
S(s)+O2(g) SO2(g) K2 ΔH2
则在该温度下反应H2(g)+SO2(g) O2(g)+H2S(g) K3 ΔH3
平衡常数K3=__________(用含有K1 K2的式子表示);
其反应热ΔH3=________(用含有ΔH1 ΔH2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:
![]()
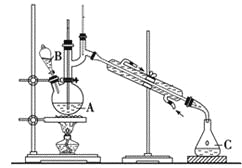
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是_____________________。
(2)加入沸石的作用是_________________。
(3)分液漏斗使用前必须进行的操作是__________________。
(4)反应温度应保持在90~95℃,其原因是___________________。
(5)本实验中,正丁醛的产率为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com