
【题目】元素及其化合物在生活及生产中有很多重要用途。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近。已知(CN)2分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为__。(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__。
(2)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式__。
【答案】3:4 异硫氰酸分子间可形成氢键,而硫氰酸不能 RbCl
【解析】
(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近.已知(CN)2分子中所有原子都满足8电子稳定结构,C原子形成四个共用电子对、N原子形成三个共用电子对;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键;
(2)RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,利用半径来分析晶格能相对较大的卤化物。
![]() 拟卤素如
拟卤素如![]() 、
、![]() 、
、![]() 等与卤素单质结构相似、性质相近.已知
等与卤素单质结构相似、性质相近.已知![]() 分子中所有原子都满足8电子稳定结构,C原子形成四个共用电子对、N原子形成三个共用电子对,
分子中所有原子都满足8电子稳定结构,C原子形成四个共用电子对、N原子形成三个共用电子对,![]()
![]() 结构式为
结构式为![]() ,每个分子中含有4个
,每个分子中含有4个![]() 键,3个
键,3个![]() 键,则其分子中
键,则其分子中![]() 键与
键与![]() 键数目之比为3:4;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
键数目之比为3:4;能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:3:4;异硫氰酸分子间可形成氢键,而硫氰酸不能;
![]() 加热时会分解为晶格能相对大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,则A为RbCl,故答案为:RbCl;
加热时会分解为晶格能相对大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子的半径,则RbCl的离子键长小于RbI的离子键长,则RbCl的晶格能较大,则A为RbCl,故答案为:RbCl;
故答案为:RbCl。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的简化电子排布式为 ________。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为_________。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为_______。
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为__________。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于___________________________。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO] 的酸性由强到弱的顺序为_________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
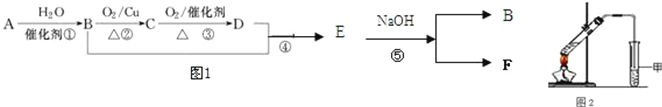
(1)B分子中官能团的名称是________,D中官能团的名称是_________;反应①的反应类型是__________反应。
(2)反应②的化学方程式是________________________________________,反应⑤的化学方程式是_________________________________________________。
(3)①某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiC、GaN、GaP、GaAs等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射的应用性能而成为半导体领域研究热点。试回答下列问题:
(1)碳的基态原子L层电子轨道表达式为__,砷属于__区元素。
(2)N与氢元素可形成一种原子个数比为1:1的粒子,其式量为60,经测定该粒子中有一正四面体构型,判断该粒子中存在的化学键__。
A.配位键 B.极性共价键 C.非极性共价键 D.氢键
(3)CaC2晶体的晶胞结构与NaCl晶体的相似(如图1所示),但CaC2晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为__。
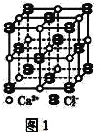
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是
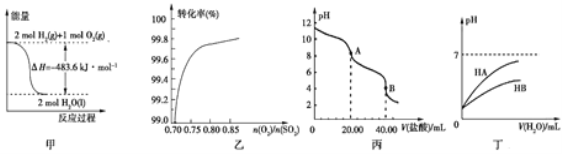
A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___。
(2)在[Fe(CN)6]3-中不存在的化学键有__。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__;分子中σ键和π键数目之比为__。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是__。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
(5)与C22-互为等电子体的微粒__(写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__nm(用含有d、NA的代数式表示)。
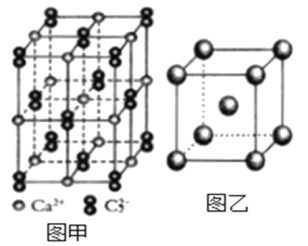
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com