
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___。
(2)在[Fe(CN)6]3-中不存在的化学键有__。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__;分子中σ键和π键数目之比为__。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是__。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
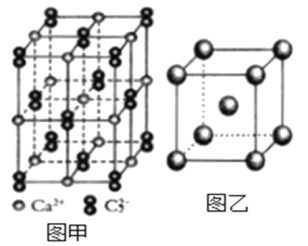
(5)与C22-互为等电子体的微粒__(写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__nm(用含有d、NA的代数式表示)。
【答案】[Ar]3d6或1s22s22p63s23p63d6 BD C<O<N sp、sp2 2:1 AC N2 4 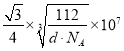
【解析】
铁的原子序数为26,基态Fe失去4s上2个电子形成Fe2+;[Fe(CN)6]3-为阴离子,是配合物的内界;KCNO中K为金属元素,易失去电子,第一电离能最小,C、N、O位于第二周期;
丙烯腈中含有碳碳双键和碳氮叁键,双键中含有1个σ键和1个π键、叁键中1个σ键和2个π键;看正负电荷中心是否重叠,分子对称则为非极性分子,不对称的为极性分子;等电子体是原子数与电子数分别相同的物质;铁单质的晶胞模型为体心立方堆积,一个晶胞中铁原子的个数为![]() 。
。
(1)铁的核外电子排布式为[Ar]3d64s2,,基态Fe失去4s上2个电子形成Fe2+,则基态Fe2+核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6。
(2)[Fe(CN)6]3-为阴离子,是配合物的内界,含有配位键,C与N原子间有极性共价键,但金属键存在于金属晶体中,氢键为分子间作用力,不是化学键,故选BD。
(3)①N的核外电子排布为1s22s22p3,为半充满状态,能量最低,则N的第一电离能大于O,C和O位于同一周期,C的原子半径大于O,则C的第一电离能小于O,故第一电离能由小到大排序为C<O<N。
②丙烯腈(H2C=CH-C≡N)分子中碳原子VSEPR构型有两种形式为平面三角形和直线形,故轨道杂化类型是sp、sp2;碳碳双键中含有1个σ键和1个π键、碳氮叁键中1个σ键和2个π键,碳氢单键均为σ键,故分子中σ键和π键的数目之比为6:3=2:1。
(4)A.Fe(CO)5为三角双锥结构,分子中正负电荷分布均匀,则Fe(CO)5对称是非极性分子,CO不对称是极性分子,A正确;
B.铁的杂化轨道数为5,与5个CO形成5个配位键,不是sp3杂化,B错误;
C.1个Fe(CO)5中铁原子与5个CO形成配位键,在每个CO分子中含有1个配位键,故有10mol配位键,故1molFe(CO)5含有10mol配位键,C正确;
D.反应Fe(CO)5=Fe+5CO属于化学变化,化学反应的实质为旧化学键断裂和新化学键形成,故反应中有新化学键生成,D错误;
答案选AC。
(5)等电子体是原子数与电子数分别相同的物质,C22-的原子数为2,电子数为14,则与其互为等电子体的微粒有N2、O22+等;依据晶胞示意图可知,晶胞的一个平面的长与宽不相等,再由体心的Ca2+可知,晶体中每个Ca2+周围距离最近的C22-数目为4。
(6)由图可知,铁单质的晶胞模型为体心立方堆积,一个晶胞中铁原子的个数为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,则为晶胞的体积为
,则为晶胞的体积为![]() ,边长为
,边长为 ,铁原子的半径r与晶胞边长a的关系为4r=
,铁原子的半径r与晶胞边长a的关系为4r=![]() a,故铁原子的半径为
a,故铁原子的半径为 。
。


科目:高中化学 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近。已知(CN)2分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为__。(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__。
(2)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l) ![]() C10H12(l)+3H2(g) △H1②C10H12(l)
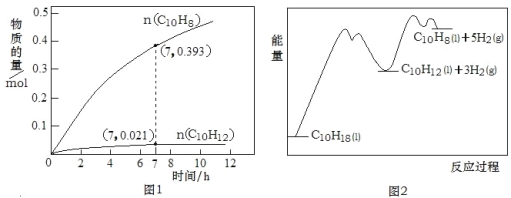
C10H12(l)+3H2(g) △H1②C10H12(l)![]() C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
下列判断正确的是( )
A. 反应至7h时,C10H18的转化率为2.1%
B. 在7h时,反应体系中氢气的物质的量为0.849mol
C. 反应①的活化能高于反应②的活化能
D. △H2>△H1>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象、结论及其推理都正确的是 ( )
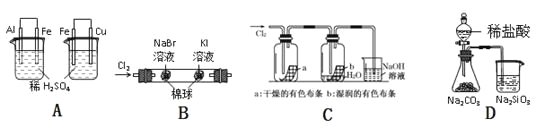
实验 | 实验现象 | 结论 |
A | 左烧杯中铁不断溶解,右烧杯中铁表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | a中布条不褪色,b中布条褪色 | 干燥氯气无漂白性,潮湿的氯气有漂泊性 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如下装置合成化工原料正丁醛。发生的反应如下:
![]()
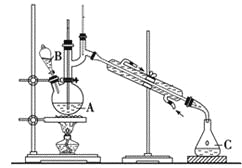
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在C中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,再将有机层干燥、蒸馏后得正丁醛2.0 g。
回答下列问题:
(1)实验中不能将Na2Cr2O7溶液加到浓硫酸中的理由是_____________________。
(2)加入沸石的作用是_________________。
(3)分液漏斗使用前必须进行的操作是__________________。
(4)反应温度应保持在90~95℃,其原因是___________________。
(5)本实验中,正丁醛的产率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
② 1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是_______________________。
(aq)的热化学方程式是_______________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4) 已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1 ②
O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________。
(5) 已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
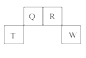
(1)T的原子结构示意图为__,Q元素用于考古学的一种同位素的符号为__,T离子的半径__(填“>”、“<”、“=”)短周期最活泼金属元素的离子半径。
(2)元素Q的最高价氧化物对应水化物的__性(填“酸”、“碱”或“中”)__(填“强于”或“弱于”)W的最高价氧化物对应水化物,故元素的非金属性:Q__W(填“强于”或“弱于”)。
(3)R的氢化物电子式为__,其水溶液呈__性(填“酸”、“碱”或“中”性),实验室常用两种固体共热制取它,其化学方程式为__。
(4)原子序数比R多1的元素的一种氢化物属于四核化合物,该物质属于__(填“离子化合物”、“共价化合物”),用电子式表示其形成过程__。
(5)R有多种氧化物,其中氧化物甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】桥环烷烃双环[2.2.1]庚烷的结构简式如图所示,下列关于该化合物的说法错误的是
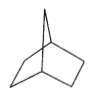
A. 与环庚烯互为同分异构体
B. 二氯代物结构有9种
C. 所有碳原子不能处于同一平面
D. 1mol双环[2.2.1]庚烷完全燃烧至少需要10 molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g)![]() 2Z(g) ΔH=-akJ·mol-1,一定条件下将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是( )
2Z(g) ΔH=-akJ·mol-1,一定条件下将1molX和3molY通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol。下列说法正确的是( )
A.10min内,Y的平均反应速率为0.03mol·L-1·s-1
B.第10min时,X的反应速率为0.01mol·L-1·min-1
C.10min内,消耗0.2molX,生成0.2molZ
D.10min内,X和Y反应放出的热量为0.2akJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com