
ЁОЬтФПЁП(1) дкЮЂЩњЮязїгУЕФЬѕМўЯТЃЌNH![]() ОЙ§СНВНЗДгІБЛбѕЛЏГЩNO
ОЙ§СНВНЗДгІБЛбѕЛЏГЩNO![]() ЁЃСНВНЗДгІЕФФмСПБфЛЏЪОвтЭМШчЯТЃК
ЁЃСНВНЗДгІЕФФмСПБфЛЏЪОвтЭМШчЯТЃК

Ђй ЕквЛВНЗДгІЪЧ________(ЬюЁАЗХШШЁБЛђЁАЮќШШЁБ)ЗДгІЃЌХаЖЯвРОнЪЧ________________ЁЃ
Ђк 1 mol NH![]() (aq)ШЋВПбѕЛЏГЩNO
(aq)ШЋВПбѕЛЏГЩNO![]() (aq)ЕФШШЛЏбЇЗНГЬЪНЪЧ_______________________ЁЃ
(aq)ЕФШШЛЏбЇЗНГЬЪНЪЧ_______________________ЁЃ
(2) вбжЊКьСзБШАзСзЮШЖЈЃЌдђЗДгІP4(АзСзЃЌs)ЃЋ5O2(g)===2P2O5(s)ЁЁІЄH1ЃЛ4P(КьСзЃЌs)ЃЋ5O2(g)===2P2O5(s)ЁЁІЄH2ЃЛІЄH1КЭІЄH2ЕФЙиЯЕЪЧІЄH1________ІЄH2 (ЬюЁА>ЁБЁА<ЁБЛђЁАЃНЁБ)ЁЃ
(3) дк298 KЁЂ101 kPaЪБЃЌвбжЊЃК2H2O(g)===O2(g)ЃЋ2H2(g)ЁЁІЄH1
Cl2(g)ЃЋH2(g)===2HCl(g)ЁЁІЄH2
2Cl2(g)ЃЋ2H2O(g)===4HCl(g)ЃЋO2(g)ЁЁІЄH3
дђІЄH3гыІЄH1КЭІЄH2жЎМфЕФЙиЯЕе§ШЗЕФЪЧ________ЁЃ
AЃЎІЄH3ЃНІЄH1ЃЋ2ІЄH2 BЃЎІЄH3ЃНІЄH1ЃЋІЄH2
CЃЎІЄH3ЃНІЄH1Ѓ2ІЄH2 DЃЎІЄH3ЃНІЄH1ЃІЄH2
(4) вбжЊЃК
2CO(g)ЃЋO2(g)===2CO2(g) ІЄHЃНЃ566 kJЁЄmolЃ1 Ђй
Na2O2(s)ЃЋCO2(g)===Na2CO3(s)ЃЋ![]() O2(g) ІЄHЃНЃ226 kJЁЄmolЃ1 Ђк
O2(g) ІЄHЃНЃ226 kJЁЄmolЃ1 Ђк
дђCO(g)гыNa2O2(s)ЗДгІЗХГі509 kJШШСПЪБЃЌЕчзгзЊвЦЪ§ФПЮЊ________________ЁЃ
(5) вбжЊH2(g)ЃЋBr2(l)===2HBr(g)ЁЁІЄHЃНЃ72 kJЁЄmolЃ1ЃЌеєЗЂ1 mol Br2(l)ашвЊЮќЪеЕФФмСПЮЊ30 kJЃЌЦфЫћЯрЙиЪ§ОнШчЯТБэЃК
ЮяжЪ | H2(g) | Br2(g) | HBr(g) |
1 molЗжзгжаЕФЛЏбЇМќЖЯ СбЪБашвЊЮќЪеЕФФмСП(kJ) | 436 | 200 | a |
дђБэжаaЃН________ЁЃ
ЁОД№АИЁП ЗХШШ ІЄH<0(ЛђЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСП) NH![]() (aq)ЃЋ2O2(g)===NO
(aq)ЃЋ2O2(g)===NO![]() (aq)ЃЋ2HЃЋ(aq)ЃЋH2O(l)ЁЁІЄHЃНЃ346 kJЁЄmolЃ1 < A 1.204ЁС1024 (Лђ2NA) 369
(aq)ЃЋ2HЃЋ(aq)ЃЋH2O(l)ЁЁІЄHЃНЃ346 kJЁЄmolЃ1 < A 1.204ЁС1024 (Лђ2NA) 369
ЁОНтЮіЁП(1)ЂйгЩЭМПЩжЊЃЌьЪБфаЁгк0ЃЌМДЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСПЃЌЫљвдЗДгІЮЊЗХШШЗДгІЃЌЙЪД№АИЮЊЃКЗХШШЃЛЗДгІЮяЕФзмФмСПДѓгкЩњГЩЮяЕФзмФмСПЃЛ
ЂкЕквЛВНЕФШШЛЏбЇЗНГЬЪНЮЊNH4+(aq)+1.5O2(g)ЈTNO2-(aq)+2H+(aq)+H2O(l)ЃЌЁїH=-273kJ/molЃЌЕкЖўВНЕФШШЛЏбЇЗНГЬЪНЮЊЃКNO2-(aq)+0.5O2(g)ЈTNO3-(aq)ЃЌЁїH=-73kJ/molЃЌИљОнИЧЫЙЖЈТЩдђNH4+(aq)+2O2(g)ЈT2H+(aq)+H2O(l)+NO3-(aq)ЃЌЁїH=-346 kJ/molЃЌЙЪД№АИЮЊЃКNH4+(aq)+2O2(g)ЈT2H+(aq)+H2O(l)+NO3-(aq)ЃЌЁїH=-346 kJ/molЃЛ
(2)Ђй4P(АзСзЃЌs)+5O2(g)=2P2O5(s)ЁїH1ЃЌЂкP4(КьСзЃЌs)+5O2(g)=2P2O5(s)ЁїH2ЃЌЂй-ЂкЕУЕНЗДгІЃК4P(КьСзЃЌs)=P4(АзСзЃЌs)ЁїH=ЁїH2-ЁїH2ЃЌКьСзБШАзСзЮШЖЈЃЌЫЕУїКьСзЕФФмСПЕЭгкАзСзЃЌИУЗДгІЪЧЮќШШЗДгІЃЌМДЁїH2-ЁїH1ЃО0ЃЌМДЁїH2ЃОЁїH1ЃЌЙЪД№АИЮЊЃКЃМЃЛ(3)Ђй2H2O(g)ЈTO2(g)+2H2(g)ЁїH1ЃЛЂкCl2(g)+H2(g)ЈT2HCl(g)ЁїH2ЃЛЂл2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)ЁїH3ЃЛдђЗДгІЂл=2ЁСЂк+ЂйЃЌгЩИЧЫЙЖЈТЩПЩжЊЃЌЁїH3=ЁїH1+2ЁїH2ЃЌЙЪД№АИЮЊЃКAЃЛ
(4) вбжЊЃКЂй2CO(g)+O2(g)=2CO2(g)ЃЛЁїH=-566kJ/molЃЌЂкNa2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)ЃЛЁїH=-226kJ/molЃЌИљОнИЧЫЙЖЈТЩЃЌЂкЁС2+ЂйПЩЕУЃК2CO(g)+2Na2O2(s)=2 Na2CO3(s) ЁїH=-1018kJ/molЃЌCO(g)гыNa2O2(s)ЗДгІЗХГі509kJШШСПЪБЃЌВЮМгЗДгІCOЮЊ2molЁС
O2(g)ЃЛЁїH=-226kJ/molЃЌИљОнИЧЫЙЖЈТЩЃЌЂкЁС2+ЂйПЩЕУЃК2CO(g)+2Na2O2(s)=2 Na2CO3(s) ЁїH=-1018kJ/molЃЌCO(g)гыNa2O2(s)ЗДгІЗХГі509kJШШСПЪБЃЌВЮМгЗДгІCOЮЊ2molЁС![]() =1molЃЌЗДгІЕФЕчзгзЊвЦЪ§ЮЊ2molЃЌМДЕчзгзЊвЦЪ§ЮЊ1.204ЁС1024ЃЌЙЪД№АИЮЊЃК1.204ЁС1024ЃЛ
=1molЃЌЗДгІЕФЕчзгзЊвЦЪ§ЮЊ2molЃЌМДЕчзгзЊвЦЪ§ЮЊ1.204ЁС1024ЃЌЙЪД№АИЮЊЃК1.204ЁС1024ЃЛ
(5)H2(g)+Br2(l)=2HBr(g)ЁїH=-72kJ/molЃЌеєЗЂ1 mol Br2(l)ашвЊЮќЪеЕФФмСПЮЊ30 kJЃЌдђH2(g)+Br2(g)=2HBr(g)ЁїH=-102kJ/molЃЌЁїH=ЗДгІЮяМќФм-ЩњГЩЮяМќФмЃЌдђга-102=436+200-2aЃЌa=369ЃЌЙЪД№АИЮЊЃК369ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЗДгІЃК2NO(g)ЃЋ2CO(g)![]() 2CO2(g)ЃЋN2(g) ЁїHЃНЃ746.8kJЁЄmolЃ1ЃЌПЩОЛЛЏЦћГЕЮВЦјЃЌШчЙћвЊЭЌЪБЬсИпИУЗДгІЕФЫйТЪКЭNOЕФзЊЛЏТЪЃЌВЩШЁЕФДыЪЉЪЧ
2CO2(g)ЃЋN2(g) ЁїHЃНЃ746.8kJЁЄmolЃ1ЃЌПЩОЛЛЏЦћГЕЮВЦјЃЌШчЙћвЊЭЌЪБЬсИпИУЗДгІЕФЫйТЪКЭNOЕФзЊЛЏТЪЃЌВЩШЁЕФДыЪЉЪЧ
A. НЕЕЭЮТЖШ B. ЫѕаЁЬхЛ§ЪЙбЙЧПдіДѓ
C. Щ§ИпЮТЖШЭЌЪБГфШыN2 D. МАЪБНЋCO2КЭN2ДгЗДгІЬхЯЕжавЦзп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПЗЂЯжЃЌЯѕЫсдНЯЁЃЌЛЙдВњЮяжаЕЊдЊЫиЕФЛЏКЯМлдНЕЭЁЃФГЭЌбЇШЁЪЪСПЕФЬњТСКЯН№гызуСПКмЯЁЕФЯѕЫсГфЗжЗДгІЃЌУЛгаЦјЬхЗХГіЁЃдкЗДгІНсЪјКѓЕФШмвКжаЃЌж№ЕЮМгШы4 molL-1ЕФNaOH ШмвКЃЌЫљМгNaOHШмвКЬхЛ§(mL)гыВњЩњЕФГСЕэЕФЮяжЪЕФСПЃЈmol)ЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. OCЖЮРызгЗДгІЗНГЬЪНЃКH++OH-==H2O
B. ШмвКжа n(NH4+) =0.012 mol
C. ШмвКжаНсКЯOH-ФмСІзюЧПЕФРызгЪЧH+ЃЌзюШѕЕФРызгЪЧAl3+
D. гћВтЖЈFЕуГСЕэЕФжЪСПЃЌЪЕбщВНжшЪЧЙ§ТЫЁЂЯДЕгЁЂИЩдяЁЂГЦСП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗДгІm AЃЋn B![]() p CдкФГЮТЖШЯТДяЕНЦНКт
p CдкФГЮТЖШЯТДяЕНЦНКт
ЂйШєAЁЂBЁЂCЖМЪЧЦјЬхЃЌМѕбЙКѓе§ЗДгІЫйТЪаЁгкФцЗДгІЫйТЪЃЌдђmЁЂnЁЂpЕФЙиЯЕЪЧ ЁЃЂкШєCЮЊЦјЬхЃЌЧвm + n = pЃЌдкМгбЙЪБЛЏбЇЦНКтЗЂЩњвЦЖЏЃЌдђЦНКтБиЖЈЯђ______ЗНЯђвЦЖЏЁЃ
ЂлШчЙћдкЬхЯЕжадіМгЛђМѕЩйBЕФСПЃЌЦНКтОљВЛЗЂЩњвЦЖЏЃЌдђBПЯЖЈВЛФмЮЊ______ЬЌЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛиД№ЯТСавдЯТгаЙиУИЕФЮЪЬтЃК
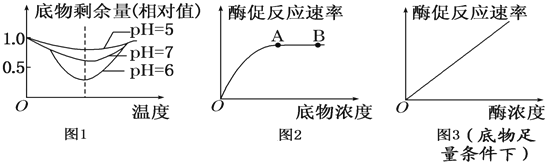
ЃЈ1ЃЉгЩЭМ1ЧњЯпПЩжЊЃКЕБpHДг5ЩЯЩ§ЕН7ЃЌУИЛюадЕФБфЛЏЙ§ГЬЪЧ ЃЛДгЭМЪОЧњЯпЛЙПЩвдЕУГіЕФНсТлЪЧ ЃЎ
ЃЈ2ЃЉЭМ2КЭЭМ3ЪЧЕзЮяХЈЖШКЭУИХЈЖШЖдУИДйЗДгІЕФгАЯьЧњЯпЃЌЧыЗжЮіЛиД№ЃК
ЭМ2жаAЕуКѓУИДйЗДгІЕФЫйТЪВЛдйдіМгЃЌЦфЯожЦадвђЫижївЊЪЧ ЃЎДгЭМ3ПЩвдЕУГіЕФНсТлЪЧЃКдкЕзЮязуСПЕФЬѕМўЯТЃЌ ЃЎ
ЃЈ3ЃЉвдЯТЪЧвЛИігаЙиУИЕФЪЕбщЃЌИљОнБэИёФкШнЗжЮіЛиД№ЯТСаЮЪЬтЃК
ВйзїВНжш | ВйзїЗНЗЈ | ЪдЙмA | ЪдЙмB | ЪдЙмC |
1 | МгЕэЗлШмвК | 2mL | 2mL | 2mL |
2 | МгЕэЗлУИШмвК | 1mL | 1mL | 1mL |
3 | ЮТЖШДІРэ | 60Ёц | 100Ёц | 0Ёц |
4 | МгЕтвК | 2ЕЮ | 2ЕЮ | 2ЕЮ |
ЂйБэжаЮЊЬНОП ЕФЪЕбщЃЎ
ЂкЧыжИГіЪЕбщВйзїВНжшДцдкЕФЮЪЬт ЃЎ
ЂлИУЪЕбщАбЮТЖШДІРэИФЮЊpHЗжБ№ЮЊ5ЁЂ7ЁЂ9ФмЗёгУгкЬНОПpHЖдУИЛюадЕФгАЯьЃП ЫЕУїРэгЩ ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЏбЇЪНжЛБэЪОвЛжжДПОЛЮяЕФЪЧ( )
AЃЎC2H6 BЃЎC4H10 CЃЎC2H4Cl2 DЃЎC
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЪЕбщЪвРяЃЌЯТСавЉЦЗЗХдкПеЦјжаВЛЛсБфжЪЕФЪЧ( )
A. СђЫсФЦ B. ХЈЯѕЫс C. Й§бѕЛЏФЦ D. ЧтбѕЛЏФЦ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
A.CS2ЁЂSO3ЖМЪЧМЋадМќЙЙГЩЕФЗЧМЋадЗжзг
B.дк[Co(NH3)4Cl2]+жаДцдкХфЮЛМќЧвХфЮЛЪ§ЪЧ4
C.дЊЫиЕквЛЕчРыФмдНДѓЕФдзгЃЌЗЧН№ЪєаддНЧП
D.УПИіИЩБљЕФОЇАћжаеМга14ИіCO2Зжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭММзЪЧH2O2УИЛюадЪмpHгАЯьЕФЧњЯпЃЌЭМввБэЪОдкзюЪЪЮТЖШЯТЃЌpH=bЪБH2O2ЗжНтВњЩњЕФO2СПЫцЪБМфЕФБфЛЏЃЎШєИУУИДйЗДгІЙ§ГЬжаИФБфФГвЛГѕЪМЬѕМўЃЌвдЯТИФБфе§ШЗЕФЪЧЃЈ ЃЉ

AЃЎpH=aЪБЃЌeЕуЯТвЦЃЌdЕузѓвЦ
BЃЎpH=cЪБЃЌeЕуЮЊ0
CЃЎЮТЖШНЕЕЭЪБЃЌeЕуВЛвЦЃЌdЕугввЦ
DЃЎH2O2СПдіМгЪБЃЌeЕуЩЯвЦЃЌdЕузѓвЦ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com