
【题目】下列实验现象、结论及其推理都正确的是 ( )
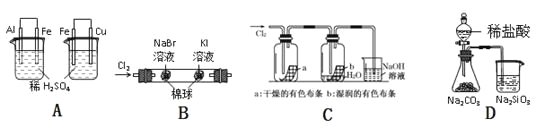
实验 | 实验现象 | 结论 |
A | 左烧杯中铁不断溶解,右烧杯中铁表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | a中布条不褪色,b中布条褪色 | 干燥氯气无漂白性,潮湿的氯气有漂泊性 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是
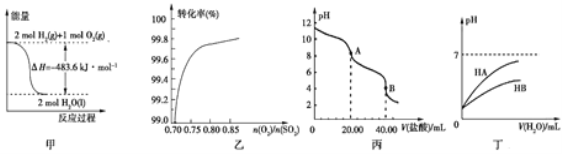
A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,往0.001mol·L-1的氨水中滴入几滴酚酞试液时,溶液呈现粉红色。现采取下列措施,其中能使滴有酚酞的氨水溶液颜色变浅的是
A.往溶液中滴入0.2mol·L-1的氨水
B.往溶液中加入NH4Cl晶体
C.往溶液中加入CH3COONa固体
D.往溶液中加入NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】335℃时,在恒容密闭反应器中1.00mol![]() 催化脱氢的反应过程如下:
催化脱氢的反应过程如下:
反应1:![]()
反应2:![]()
测得![]() 和
和![]() 的产率
的产率![]() 和
和![]() (以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
(以物质的量分数计)随时间的变化关系及反应过程中能量的变化如图所示。下列说法错误的是( )
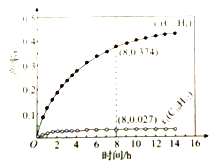
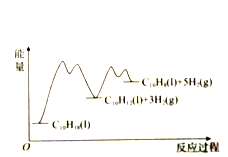
A. 使用催化剂能改变反应历程
B. 更换催化剂后![]() 、
、![]() 也会随之改变
也会随之改变
C. 8h时,反应1、2都未处于平衡状态
D. ![]() 显著低于
显著低于![]() ,是由于反应2的活化能比反应1的小,反应1生成的
,是由于反应2的活化能比反应1的小,反应1生成的![]() 很快转变成
很快转变成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA
B.1mol重水与1mol水中,中子数比为2:1
C.5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA
D.标准状况下,11.2L二氧化碳与和足量的过氧化钠反应,转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态Fe2+核外电子排布式为___。
(2)在[Fe(CN)6]3-中不存在的化学键有__。
A.共价键 B.金属键 C.配位键 D.离子键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2OKCN+HCl=HCN+KCl
HC≡CH+HCN→H2C=CH-C≡N
①KCNO中非金属元素原子的第一电离能由小到大排序为__。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是__;分子中σ键和π键数目之比为__。
(4)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

关于Fe(CO)5,下列说法正确的是__。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
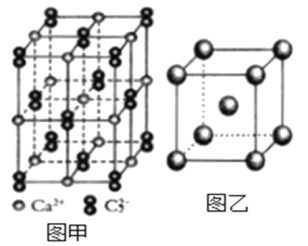
(5)与C22-互为等电子体的微粒__(写出一种),CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为__。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为__nm(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:

这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________ 。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。
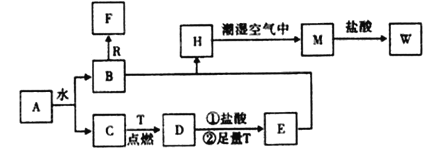
(1)物质A的化学式为___。
(2)B和R在溶液中反应生成F的离子方程式为___。
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,A可以作为呼吸面具的___。
(5)W和T反应的离子方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com