
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA
B.1mol重水与1mol水中,中子数比为2:1
C.5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA
D.标准状况下,11.2L二氧化碳与和足量的过氧化钠反应,转移的电子数为0.5NA
【答案】B
【解析】
A.一个甲烷分子由4个C-H键结合成正四面体;
B.重水分子为2H216O,水分子为1H216O;
C.乙烯(C2H4)和环丁烷(C4H8)最简式均为CH2,乙烯(C2H4)和环丁烷(C4H8)的混合气体可以看成是由一定物质的量的CH2组成的,且式量=12+2=14;
D.![]() ,过氧化钠中4个-1价的O有2个升高到0价,2个降低到0价,故与方程式对应的转移电子数为2e-。
,过氧化钠中4个-1价的O有2个升高到0价,2个降低到0价,故与方程式对应的转移电子数为2e-。
A.标准状况下,n(CH4)=![]() =0.1mol,每个CH4分子中含4个C-H键,所以n(碳氢键)=0.1mol×4=0.4mol,所以标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA,A正确;
=0.1mol,每个CH4分子中含4个C-H键,所以n(碳氢键)=0.1mol×4=0.4mol,所以标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA,A正确;
B.重水分子为2H216O,水分子为1H216O,一个2H中中子数=2-1=1,一个H中中子数=1-1=0,一个16O中中子数=16-8=8,所以一个重水分子中中子数=1×2+8=10,一个水分子中中子数=0×2+8=8,所以1mol重水与1mol水中,中子数比为10:8=5:4,B错误;
C.乙烯(C2H4)和环丁烷(C4H8)最简式均为CH2,乙烯(C2H4)和环丁烷(C4H8)的混合气体可以看成是由一定物质的量的CH2组成的,且n(CH2)=![]() =0.4mol,所以n(C)=0.4mol×1=0.4mol,即5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA,C正确;
=0.4mol,所以n(C)=0.4mol×1=0.4mol,即5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA,C正确;
D.标况下,11.2L二氧化碳的物质的量=![]() =0.5mol,由
=0.5mol,由![]() 可知,每2mol二氧化碳反应对应转移2mol电子, 所以0.5mol二氧化碳与和足量的过氧化钠反应,转移的电子的物质的量为0.5mol,即电子数为0.5NA,D正确。
可知,每2mol二氧化碳反应对应转移2mol电子, 所以0.5mol二氧化碳与和足量的过氧化钠反应,转移的电子的物质的量为0.5mol,即电子数为0.5NA,D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)气态氟化氢中存在二聚分子(HF)2,这是由于__。
(2)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为__,中心I原子的杂化轨道类型为__。
(3)基态溴原子的电子排布式为__,碘原子价电子的电子排布图为__。
(4)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为__,I和Cl相比,电负性较大的是__,ICl中I元素的化合价为__。
(5)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为__(填序号)。
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物和卤素互化物,该反应的化学方程式为__。RbICl2的晶体结构与CsCl相似,晶胞边长为685.5pm,RbICl2晶胞中含有__个氯原子,RbICl2晶体的密度是__gcm-3(只要求列算式,不必计算出数值.阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇![]() 制备环己烯.已知:
制备环己烯.已知:
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入1ml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
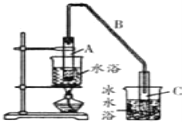
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______。
②写出环已醇制备环已烯的化学反应方程式___________________________。
③试管C置于冰水浴中的目的是____________________________。
(2)环已烯粗品中含有环已醇和少量酸性杂质等需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在_______层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环已烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验),请回答下列问题:
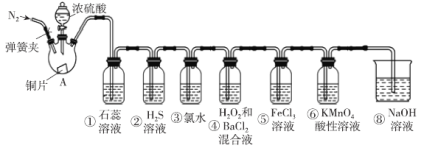
(1)在A中发生反应的化学方程式为___。
(2)①中的实验现象为紫色石蕊溶液___。
②中的实验现象为___,写出此化学反应方程式___。
③中的实验现象是___,写出此化学反应方程式___。
④中的实验现象是___,写出此化学反应方程式___。
⑤中的现象是溶液由黄色变为浅绿色,其反应的离子方程式为___。
(3)能体现出SO2还原性的实验序号是___。
(4)实验结束后需要通入N2,其目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象、结论及其推理都正确的是 ( )
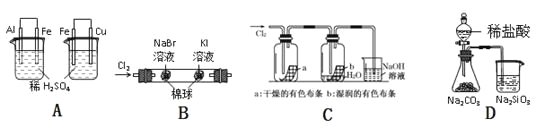
实验 | 实验现象 | 结论 |
A | 左烧杯中铁不断溶解,右烧杯中铁表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | a中布条不褪色,b中布条褪色 | 干燥氯气无漂白性,潮湿的氯气有漂泊性 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于焓变![]() 的叙述或判断正确的是
的叙述或判断正确的是![]()
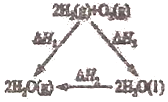
A.据如图可知:![]()
B.由![]() 可知,若将含1mol
可知,若将含1mol![]() 的稀溶液与含1molNaOH的稀溶液混合,放出的热量为
的稀溶液与含1molNaOH的稀溶液混合,放出的热量为![]()
C.![]() 、30MPa下,将
、30MPa下,将![]() 和
和![]() 置于密闭容器中充分反应,放出
置于密闭容器中充分反应,放出![]() 热量,则反应
热量,则反应![]() 的
的![]()
D.![]() 在常温下能自发进行,则该反应的
在常温下能自发进行,则该反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
② 1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是_______________________。
(aq)的热化学方程式是_______________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4) 已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1 ②
O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________。
(5) 已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Ni原子核外有__种运动状态不同的电子,M层的电子云有__种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Se的第一电离能低于As,原因是___。
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO2-中大π键应表示为__。
,则NO2-中大π键应表示为__。
(4)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(5)FeO是离子晶体,其晶格能可通过图中的Born—Haber循环计算得到。
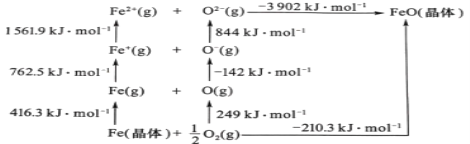
可知,O原子的第一电子亲和能为___kJmol-1,FeO晶格能为___kJmol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。
),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。

(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com