
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)气态氟化氢中存在二聚分子(HF)2,这是由于__。
(2)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为__,中心I原子的杂化轨道类型为__。
(3)基态溴原子的电子排布式为__,碘原子价电子的电子排布图为__。
(4)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为__,I和Cl相比,电负性较大的是__,ICl中I元素的化合价为__。
(5)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为__(填序号)。
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物和卤素互化物,该反应的化学方程式为__。RbICl2的晶体结构与CsCl相似,晶胞边长为685.5pm,RbICl2晶胞中含有__个氯原子,RbICl2晶体的密度是__gcm-3(只要求列算式,不必计算出数值.阿伏伽德罗常数为NA)。
【答案】HF分子间形成氢键 V形 sp3 [Ar]3d104s24p5 ![]() BrI>ICl>Cl2 Cl +1 ①②③ RbICl2
BrI>ICl>Cl2 Cl +1 ①②③ RbICl2![]() RbCl+ICl 8
RbCl+ICl 8 ![]()
【解析】
(1)F的电负性很大,HF分子之间形成氢键;
(2)I3+的成键数为2,孤对电子数为![]() ×(7-1-2×1)=2,与水相似;
×(7-1-2×1)=2,与水相似;
(3)Br的原子序数为35,最外层有7个电子,为4s、4p电子;碘原子价电子数与Br相同,为5s、5p电子;
(4)分子晶体,相对分子质量越大,沸点越高,原子的得电子能力越强,则电负性越大;
(5)含非羟基氧原子个数越多,酸性越强;
(6)根据元素守恒和原子守恒判断产物,及反应方程式;根据氯化钠的晶胞图分析;利用均摊法计算出晶胞中含有离子个数,再根据密度公式计算即可。
![]() 的电负性很大,HF分子之间形成氢键;
的电负性很大,HF分子之间形成氢键;
故答案为:HF分子间形成氢键;
![]() 的成键数为2,孤对电子数为
的成键数为2,孤对电子数为![]() ,与水相似,则空间构型为V形,中心I原子的杂化轨道类型为
,与水相似,则空间构型为V形,中心I原子的杂化轨道类型为![]() ;
;
故答案为:V形;![]() ;
;
![]() 的原子序数为35,最外层有7个电子,为4s、4p电子,则电子排布式为
的原子序数为35,最外层有7个电子,为4s、4p电子,则电子排布式为![]() ,碘原子价电子的电子排布图为
,碘原子价电子的电子排布图为![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 分子晶体,相对分子质量越大,沸点越高,则沸点为
分子晶体,相对分子质量越大,沸点越高,则沸点为![]() ,氯原子得电子能力强于I,所以Cl的电负性大,Cl显
,氯原子得电子能力强于I,所以Cl的电负性大,Cl显![]() 价,故I显
价,故I显![]() 价;
价;
故答案为:![]() ;Cl;
;Cl;![]() ;
;
![]() 含非羟基氧原子个数越多,酸性越强,非羟基氧分别为3、3、1,但非金属性
含非羟基氧原子个数越多,酸性越强,非羟基氧分别为3、3、1,但非金属性![]() ,则酸性为
,则酸性为![]() ;
;
故答案为:![]() ;
;
![]() 根据元素守恒和原子守恒判断产物为RbCl和ICl,则反应方程式为
根据元素守恒和原子守恒判断产物为RbCl和ICl,则反应方程式为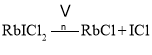 ;已知氯化钠的晶胞图为:
;已知氯化钠的晶胞图为: ,晶胞中含有4个阳离子和4个阴离子,
,晶胞中含有4个阳离子和4个阴离子,![]() 的晶体结构与NaCl相似,
的晶体结构与NaCl相似,![]() 晶胞中含有4个阴离子,则Cl原子为8个;1个晶胞中含有4个
晶胞中含有4个阴离子,则Cl原子为8个;1个晶胞中含有4个![]() ,根据
,根据![]() ,所以该晶胞的密度是
,所以该晶胞的密度是![]() ;
;
故答案为:RbICl2![]() RbCl+ICl;8;
RbCl+ICl;8;![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于消去反应的是(反应条件省略)( )
A.![]() -CH3CH2OH →
-CH3CH2OH →![]() -CH2=CH2↑+ H2O
-CH2=CH2↑+ H2O
B.CH3CH2CH3 + Br2→CH3CH2CH2Br + HBr
C.CH3CH2CHO + H2→CH3CH2CH2OH
D.2CH3CH2CH2OH + 2O2→CH3CH2CHO + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
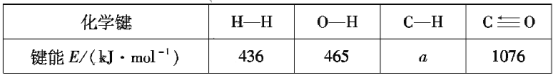
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。

某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的名称:
A.(CH3)3CCH(CH3)(CH2)2CH(C2H5)2 A的名称是________;
B.(CH3)3CC≡CCH2CH3 B的名称是____;
C.![]() C的名称是_____
C的名称是_____
D.CH2OHCH(C2H5) CH2OH D的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=+2b kJ/mol
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
O2(g)=2CO2(g)+H2O(l);ΔH=-2b kJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
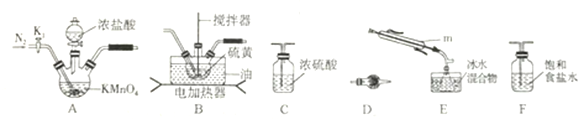
①仪器m 的名称为__________,装置F 中试剂的作用是_________。
②装置连接顺序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是______________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
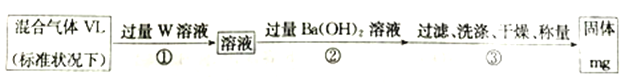
①W溶液可以是_____(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_________(用含V、m 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
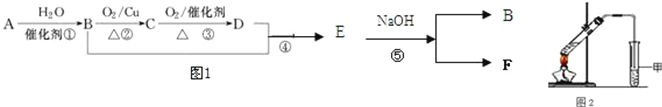
(1)B分子中官能团的名称是________,D中官能团的名称是_________;反应①的反应类型是__________反应。
(2)反应②的化学方程式是________________________________________,反应⑤的化学方程式是_________________________________________________。
(3)①某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图2所示。B的价电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的ds区,其基态原子不存在不成对电子。B与C所形成化合物晶体的晶胞如图3所示。
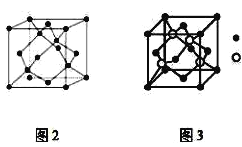
(1)A单质晶体属于__晶体(填晶体类型)。其原子杂化方式为__。
(2)B与C所形成化合物晶体的化学式__。
(3)B与C所形成化合物晶体的密度为ag/cm3,则B原子之间最近距离为__cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA
B.1mol重水与1mol水中,中子数比为2:1
C.5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA
D.标准状况下,11.2L二氧化碳与和足量的过氧化钠反应,转移的电子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com