
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
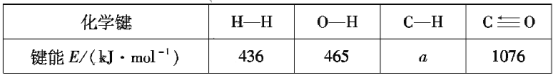
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。

某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
【答案】415.1 -41.4kJ·mol-1 ![]() AC 温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小 20%
AC 温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小 20% 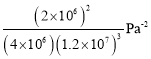
【解析】
(1)根据△H1=反应物键能-生成物键能计算a;根据盖斯定律计算△H2;
(2)根据K=![]() 计算;
计算;
(3)欲增大CH4转化为H2的平衡转化率要使平衡正向移动;
(4)温度低于T0时未达平衡,高于T0时反应达平衡,该反应是放热反应;根据压强比等于气体物质的量之比进行计算;
(1)反应CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1==4a kJ·mol-1+2×465 kJ·mol-1-(1076 kJ·mol-1+3×436 kJ·mol-1)= +206.4kJ·mol-1,解得a=415.1 kJ·mol-1;ⅢCH2(g)+2H2O(g)
CO(g)+3H2(g) △H1==4a kJ·mol-1+2×465 kJ·mol-1-(1076 kJ·mol-1+3×436 kJ·mol-1)= +206.4kJ·mol-1,解得a=415.1 kJ·mol-1;ⅢCH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1,I.CH4(g)+H2O(g)
CO2(g)+4H2(g) △H=+165.0kJ·mol-1,I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1,根据盖斯定律可知II=Ⅲ- I,所以△H2=△H-△H1=+165.0kJ·mol-1-206.4kJ·mol-1=-41.4kJ·mol-1,
CO(g)+3H2(g) △H1=+206.4kJ·mol-1,根据盖斯定律可知II=Ⅲ- I,所以△H2=△H-△H1=+165.0kJ·mol-1-206.4kJ·mol-1=-41.4kJ·mol-1,
故答案为:415.1;-41.4kJ·mol-1;
(2)由n(CO2)=dmol可知反应II生成的n(H2)= dmol,同时消耗的n(CO)=dmol,消耗的n(H2O)=dmol,则在反应I中生成的n(CO)=(b+d)mol,消耗的n(CH4)= (b+d)mol,消耗的n(H2O)= (b+d)mol,生成的n(H2)=(3b+3d)mol,则平衡时体系内:n(CH4)=(1-b-d)mol、n(H2O)=(4-b-2d)mol、n(CO)=bmol、n(H2)=(3b+4d)mol,容器体积为2L,故平衡常数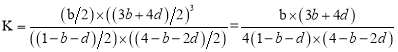 ,
,
故答案为:![]() ;
;
(3)A.适当增大反应物投料比武n(H2O):n(CH4),增大水的量促进甲烷转化成CO,促进CO转化成CO2,故A正确;
B.提高压强,反应I平衡左移,故B错误;
C.分离出CO2可使平衡右移,故C正确;
故答案为:AC;
(4)温度低于T0时未达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小;
设初始加入的N2为1 mol、H2为3 mol ,温度、体积一定时气体物质的量之比等于压强之比,气体物质的量减少4×10 % =0.4 mol;

其中p0=2×l07Pa ;
H2的转化率为0.6/3=20%;
平衡常数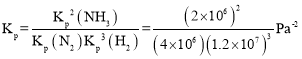
故答案为:温度低于T0时达平衡,温度升高、反应速率加快,NH3的体积分数增大;高于T0时反应达平衡,由于该反应是放热反应,温度升高平衡常数减小,NH3的体积分数减小;20%;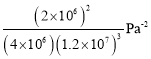 。
。


科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是

A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除环境污染有重要意义。
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
i:2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。

(2)100℃时,若将0.100 mol N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
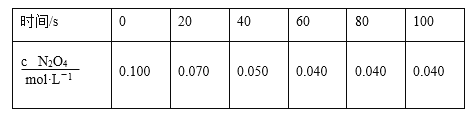
①在0~40 s时段,化学反应速率v(NO2)为______ mol·L-1·s-1
②下列能说明该反应达到平衡状态的是________(填选项字母)。
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是_________(填选项字母)。
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______kPa·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某抗酸药中碳酸钙固体的纯度(另一种成分为淀粉),称取12.5g此药片置于烧杯中,加入过量的稀盐酸,测得反应过程中烧杯和药品的总重量随时间的变化数据如下:
反应时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
烧杯和药品的总重/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
计算:(1)共收集到标准状况下CO2的体积____________________;
(2)该样品中碳酸钙的质量分数________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | |||||||
(1)表中元素__
(2)表中元素⑦的原子结构示意图为__,在周期表中的位置为____
(3)表中元素⑥⑩的氢化物的稳定性顺序为__(填写化学式,下同)。
(4)表中元素⑩的最高价氧化物对应水化物的酸性:__。
(5)表中元素②和⑦的最高价氧化物对应水化物的碱性:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液B.CH3COOHC.稀HNO3D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 为短周期元素,它们的位置关系如图所示,已知 B、C 两元素原子核内质子数之和是 A 元素的原子核内质子数的 4 倍。

(1)写出 A、B 的元素符号:A____、B____。
(2)B 在周期表中的位置为____,C 的离子结构示意图为____。
(3)A 的氢化物的分子式为____;B、C 的最高价氧化物对应的水化物的分子式分别为____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)气态氟化氢中存在二聚分子(HF)2,这是由于__。
(2)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为__,中心I原子的杂化轨道类型为__。
(3)基态溴原子的电子排布式为__,碘原子价电子的电子排布图为__。
(4)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由高到低的顺序为__,I和Cl相比,电负性较大的是__,ICl中I元素的化合价为__。
(5)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为__(填序号)。
(6)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物和卤素互化物,该反应的化学方程式为__。RbICl2的晶体结构与CsCl相似,晶胞边长为685.5pm,RbICl2晶胞中含有__个氯原子,RbICl2晶体的密度是__gcm-3(只要求列算式,不必计算出数值.阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇![]() 制备环己烯.已知:
制备环己烯.已知:
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入1ml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
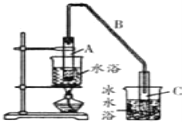
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______。
②写出环已醇制备环已烯的化学反应方程式___________________________。
③试管C置于冰水浴中的目的是____________________________。
(2)环已烯粗品中含有环已醇和少量酸性杂质等需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在_______层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环已烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com