
【题目】研究氮氧化物的反应机理,对于消除环境污染有重要意义。
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
i:2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。

(2)100℃时,若将0.100 mol N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
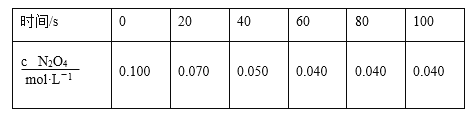
①在0~40 s时段,化学反应速率v(NO2)为______ mol·L-1·s-1
②下列能说明该反应达到平衡状态的是________(填选项字母)。
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是_________(填选项字母)。
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=_______kPa·s-1。
【答案】![]() a 0.0025 BD BC < 3.9×106
a 0.0025 BD BC < 3.9×106
【解析】
(1)①由反应达平衡状态,所以![]() ,所以
,所以![]() ,
, ![]() ,据此分析;
,据此分析;
②![]() 的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大;
的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大;
(2)①![]() ,由反应速率之比等于化学计量数之比,则
,由反应速率之比等于化学计量数之比,则![]() ;
;
②平衡状态的判定;
③利用等效平衡思想解决;
④题干中给出的数据算出平均分子量=气体总质量气体总的物质的量=![]() =57.5g/mol,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行;
=57.5g/mol,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行;
⑤列三段式解出![]() 的分压,计算即可。
的分压,计算即可。
(1)①![]() ;②
;②![]() ;目标反应
;目标反应![]() ,由反应达平衡状态,所以
,由反应达平衡状态,所以![]() ,所以
,所以![]() ,
, ![]() ,则
,则![]() ,故答案为:
,故答案为:![]() ;
;
②![]() 的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:a;
的速率随温度的升高而减小,因为决定该反应速率的是反应②,故升高到温度时v2正减小,且平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:a;
(2)①由表可知,040s时间内![]() 的浓度由0.10mol/L减小为0.050mol/L,则其反应速率为
的浓度由0.10mol/L减小为0.050mol/L,则其反应速率为![]() ,由反应速率之比等于化学计量数之比,则
,由反应速率之比等于化学计量数之比,则![]() 的反应速率为
的反应速率为![]() ,故答案为:0.0025;
,故答案为:0.0025;
②A.未体现正逆反应速率的关系,A错误;
B.体系的颜色不再改变,说明二氧化氮的浓度不变,B正确;
C.无论是否反应,体系的混合气体的总质量不变,体积不变,故密度不变,C错误;
D.该反应正反应为体积增大的反应,混合气体的压强不再改变,说明气体的物质的量不变,达到平衡状态,D正确;
故答案为:BD;
③A. 充入一定量的![]() ,相当于加压,达新平衡时,则
,相当于加压,达新平衡时,则![]() 的体积分数减小,故A错误;
的体积分数减小,故A错误;
B. 增大容器的容积,减压,平衡向体积增大的方向移动,即正向移动,![]() 的体积分数增大,故B正确;
的体积分数增大,故B正确;
C. 分离出一定量的![]() ,相当于减压,使
,相当于减压,使![]() 的体积分数增大,故C正确;
的体积分数增大,故C正确;
D. 充入一定量的![]() ,总压增大,气体分压不变,不会引起化学平衡的移动,二氧化氮浓度不变,故D错误;
,总压增大,气体分压不变,不会引起化学平衡的移动,二氧化氮浓度不变,故D错误;
故答案为:BC;
④100℃时,将0.100mol![]() 气体放入1L密闭容器中,平衡时,
气体放入1L密闭容器中,平衡时,![]() ,
,![]() ,平均分子量=气体总质量气体总的物质的量=
,平均分子量=气体总质量气体总的物质的量=![]() =57.5g/mol,将9.2g
=57.5g/mol,将9.2g![]() 和
和![]() 气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行,即
气体放入1L密闭容器中,某时刻测得容器内气体的平均相对分子质量为50,说明反应需向体积缩小的方向进行,即![]() ,故答案为:<;
,故答案为:<;
⑤当N2O4分解10%时,设投入的N2O4为1mol,转化的N2O4为0.1mol,则: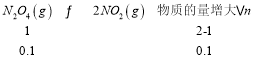 ,故此时
,故此时![]() ,则
,则![]() ,故答案为:3.9×106。
,故答案为:3.9×106。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
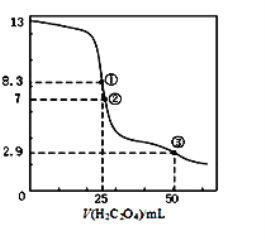
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,发生反应A(g)+B(g)![]() C(g) ΔH<0,达到平衡后根据下列图象判断:
C(g) ΔH<0,达到平衡后根据下列图象判断:
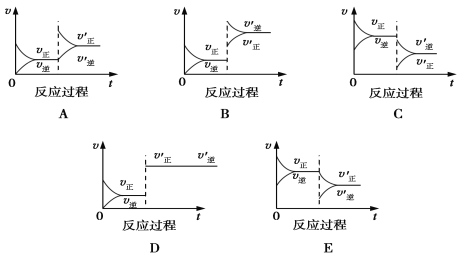
(1)表示升高温度,达到新平衡的是________(填“A”、“B”、“C”、“D”或“E”,下同),新平衡中C的质量分数________(填“增大”、“减小”或“不变”,下同)。
(2)表示降低压强,达到新平衡的是________,A的转化率________。
(3)表示减少C的量,达到新平衡的是______________。
(4)表示增加A的量,达到新平衡的是___________,此时B的转化率__________,A的转化率___________。
(5)表示使用催化剂,达到新平衡的是________________,C的质量分数________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于消去反应的是(反应条件省略)( )
A.![]() -CH3CH2OH →
-CH3CH2OH →![]() -CH2=CH2↑+ H2O
-CH2=CH2↑+ H2O
B.CH3CH2CH3 + Br2→CH3CH2CH2Br + HBr
C.CH3CH2CHO + H2→CH3CH2CH2OH
D.2CH3CH2CH2OH + 2O2→CH3CH2CHO + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM 2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
⑴ 已知:2SO2(g) + O2(g) ![]() 2SO3(g) △H =﹣196.6kJmol-1
2SO3(g) △H =﹣196.6kJmol-1
2NO(g) + O2(g) ![]() 2NO2(g) △H =﹣113.0kJmol-1
2NO2(g) △H =﹣113.0kJmol-1
则反应NO2(g) + SO2(g) ![]() SO3(g) + NO(g) △H =__________kJmol-1。
SO3(g) + NO(g) △H =__________kJmol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有__________。
a、体系密度保持不变 b、混合气体颜色保持不变
c、SO2和NO的体积比保持不变 d、每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K=________________。
⑵ CO、CO2都可用于合成甲醇。甲醇既是重要的化工原料,又可作为燃料,近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如图1所示,回答下列问题。

① Pt(a)电极是电池的______极,电极反应式为:_________________。
② 如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有________mol。
③ CO用于合成甲醇反应方程式为:CO(g) + 2H2(g)![]() CH3OH (g) ,CO在不同温度下的平衡转化率与压强的关系如图2所示。实际的生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________。
CH3OH (g) ,CO在不同温度下的平衡转化率与压强的关系如图2所示。实际的生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是____________。
⑶ 图3是一种用NH3脱除烟气中NO的原理。
① 该脱硝原理中,NO最终转化为H2O和__________(填化学式)。
② 当消耗2mol NH3和0.5mol O2时,除去的NO在标准状况下的体积为__________L。
⑷ NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图4所示,写出NO分解的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯A,其分子式C6H12O2,已知

又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A结构可能有( )
A. 5种 B. 4种 C. 3种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
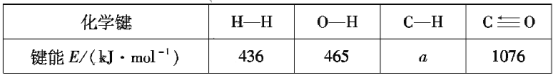
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。

某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
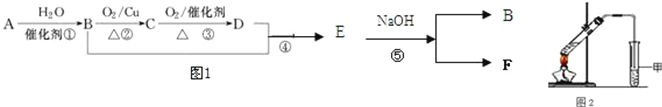
(1)B分子中官能团的名称是________,D中官能团的名称是_________;反应①的反应类型是__________反应。
(2)反应②的化学方程式是________________________________________,反应⑤的化学方程式是_________________________________________________。
(3)①某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com