
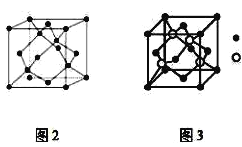
����Ŀ��A��B��CΪԭ���������ε�����ǰ�����ڵ�Ԫ�أ�A�ĵ�һ�����ܽ���þ������Ԫ��֮�䣬A���ʾ���ľ����ṹ��ͼ2��ʾ��B�ļ۵����Ų�Ϊ(n+1)sn(n+1)pn+2��Cλ��Ԫ�����ڱ���ds�������̬ԭ�Ӳ����ڲ��ɶԵ��ӡ�B��C���γɻ����ᄃ��ľ�����ͼ3��ʾ��
��1��A���ʾ�������__����(�������)����ԭ���ӻ���ʽΪ__��
��2��B��C���γɻ����ᄃ��Ļ�ѧʽ__��
��3��B��C���γɻ����ᄃ����ܶ�Ϊag/cm3����Bԭ��֮���������Ϊ__cm��
���𰸡�ԭ�� sp3 ZnS 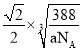 cm
cm
��������
A��B��CΪԭ���������ε�����ǰ�����ڵ�Ԫ�أ�B�ļ۵����Ų�Ϊ��n+1��sn��n+1��pn+2����n=2����BΪSԪ�أ�Cλ��λ��Ԫ�����ڱ���ds�������̬ԭ�Ӳ����ڲ��ɶԵ��ӣ���CΪZn��A�ĵ�һ�����ܽ���þ������Ԫ��֮�䣬A���ʾ���ľ����ṹ��Aԭ������Χ4��ԭ���γ��������壬Ϊ�ռ������������״�ṹ����AΪSi�������Ϸ������
![]() ��B��CΪԭ���������ε�����ǰ�����ڵ�Ԫ�أ�A�ĵ�һ�����ܽ���þ������Ԫ��֮�䣬A���ʾ���ľ����ṹ��ͼ2��ʾ������֪��AΪ���γɵľ��壬����ԭ�Ӿ��壬��ԭ���ӻ���ʽΪ
��B��CΪԭ���������ε�����ǰ�����ڵ�Ԫ�أ�A�ĵ�һ�����ܽ���þ������Ԫ��֮�䣬A���ʾ���ľ����ṹ��ͼ2��ʾ������֪��AΪ���γɵľ��壬����ԭ�Ӿ��壬��ԭ���ӻ���ʽΪ![]() ��
��
�ʴ�Ϊ��ԭ�ӣ�sp3��
![]() �ļ۵����Ų�Ϊ
�ļ۵����Ų�Ϊ![]() �����������Ӳ㣬���Ϊ6�����ӣ�BΪSԭ�ӣ�Cλ��Ԫ�����ڱ���ds�������̬ԭ�Ӳ����ڲ��ɶԵ��ӣ��ж�ΪZnԭ�ӣ�B��C���γɻ����ᄃ��Ļ�ѧʽΪ��ZnS��
�����������Ӳ㣬���Ϊ6�����ӣ�BΪSԭ�ӣ�Cλ��Ԫ�����ڱ���ds�������̬ԭ�Ӳ����ڲ��ɶԵ��ӣ��ж�ΪZnԭ�ӣ�B��C���γɻ����ᄃ��Ļ�ѧʽΪ��ZnS��
�ʴ�Ϊ��ZnS��
![]() B��C���γɻ����ᄃ����ܶ�Ϊag/cm3����Bԭ��֮���������Ϊ
B��C���γɻ����ᄃ����ܶ�Ϊag/cm3����Bԭ��֮���������Ϊ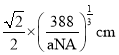 ��
��
�ʴ�Ϊ��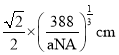 ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij����ҩ��̼��ƹ���Ĵ��ȣ���һ�ֳɷ�Ϊ���ۣ�����ȡ12.5g��ҩƬ�����ձ��У����������ϡ���ᣬ��÷�Ӧ�������ձ���ҩƷ����������ʱ��ı仯�������£�
��Ӧʱ��/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
�ձ���ҩƷ������/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
���㣺(1)���ռ�����״����CO2�����____________________��
(2)����Ʒ��̼��Ƶ���������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±�ػ�ѧ�ḻ��ʣ����γ�±���±�ػ������±����ȶ������͵Ļ����
��1����̬�������д��ڶ��۷���(HF)2����������__��
��2��I3+���ڶ�±�������ӣ�����VSEPRģ���Ʋ�I3+�Ŀռ乹��Ϊ__������Iԭ�ӵ��ӻ��������Ϊ__��
��3����̬��ԭ�ӵĵ����Ų�ʽΪ__����ԭ�Ӽ۵��ӵĵ����Ų�ͼΪ__��
��4��±�ػ�������IBr��ICl����±�ص��ʽṹ���ơ����������Cl2��IBr��ICl�е��ɸߵ��͵�˳��Ϊ__��I��Cl��ȣ��縺�Խϴ����__��ICl��IԪ�صĻ��ϼ�Ϊ__��
��5�����Ʋ��HClO4����HIO4����H5IO6[��д��(HO)5IO]�������ʵ�������ǿ������˳��Ϊ__(�����)��
��6��±����RbICl2����ʱ��ֽ�Ϊ��������Խϴ��±�����±�ػ�����÷�Ӧ�Ļ�ѧ����ʽΪ__��RbICl2�ľ���ṹ��CsCl���ƣ������߳�Ϊ685.5pm��RbICl2�����к���__����ԭ�ӣ�RbICl2������ܶ���__gcm-3(ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A��B���ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() 2C(g)��2D(g)����Ӧ���е�10 sĩ���ﵽƽ�⣬���A�����ʵ���Ϊ1.8 mol��B�����ʵ���Ϊ0.6 mol��C�����ʵ���Ϊ0.8 mol��
2C(g)��2D(g)����Ӧ���е�10 sĩ���ﵽƽ�⣬���A�����ʵ���Ϊ1.8 mol��B�����ʵ���Ϊ0.6 mol��C�����ʵ���Ϊ0.8 mol��
(1)��C��ʾ10 s�ڷ�Ӧ��ƽ����Ӧ����Ϊ______________��
(2)��ӦǰA�����ʵ���Ũ����______________��
(3)10 sĩ��������D��Ũ��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ѿ����ֵ�һ�ٶ���Ԫ���У���ϡ�������⣬�ǽ���Ԫ��ֻ��ʮ���֣������������������е���ϵ��
��1���������п������뵼����ϵ�Ԫ�ص�������������ռ���Һ��Ӧ�����ӷ���ʽ�ǣ�__________��
��2��Ϊ�����ú�������ʣ�������������Һ��������һ��Һ���ǽ������õ���������һ����̼�ڴ���������ת��Ϊ�״���д���û�ѧ��Ӧ����ʽΪ____________��
��3�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ϳɰ��ķ�Ӧ����������ʳ�����Ӧ���£�N2(g)��3H2(g)![]() 2NH3(g)��
2NH3(g)��
�ٺϳɰ��ķ�Ӧ�е������仯��ͼ��ʾ���÷�Ӧ��________��Ӧ������ȡ����ȡ�����
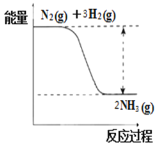
����һ�������£���2.5mol N2��7.5mol H2�Ļ������������Ϊ2L�Ĺ̶��������з�����Ӧ��N2��g��+ 3H2(g) ![]() 2NH3(g)��5����ĩʱ�ﵽƽ�⣬��������ڵ�ѹǿ�ǿ�ʼʱ��0.9������5�������ð�����ʾ�÷�Ӧ��ƽ����ѧ��Ӧ����Ϊ��V(NH3)=____________�������ﵽƽ��ʱ��ת������_____________������С�����һλ����
2NH3(g)��5����ĩʱ�ﵽƽ�⣬��������ڵ�ѹǿ�ǿ�ʼʱ��0.9������5�������ð�����ʾ�÷�Ӧ��ƽ����ѧ��Ӧ����Ϊ��V(NH3)=____________�������ﵽƽ��ʱ��ת������_____________������С�����һλ����
��4����������������ɴ���ʹ����һ������װ�ã��乹����ͼ��ʾ��
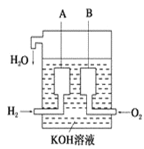
A��B�����缫���ɶ��̼����ɡ��õ�ص�������ӦʽΪ��________________����������װ���е��������ɼ��飬������ı䣬��Ӧװ�õĸ�����Ӧ����ʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A����һ��ֲ���������ڼ���A�ɷ�����ͼ��ʾ��һϵ�л�ѧ��Ӧ�����Т٢ڢ�����ͬ�ַ�Ӧ���͡�������ͼ�ش��������⣺

��1��д���ṹ��ʽ��B___��D___��
��2��д���ڡ���������Ӧ�Ļ�ѧ����ʽ����ע����Ӧ����
��__����Ӧ����__��
��__����Ӧ����__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���Ի�����![]() �Ʊ�����ϩ.��֪��
�Ʊ�����ϩ.��֪��
�ܶȣ�g/cm3�� | �ܵ㣨�棩 | �е㣨�棩 | �ܽ��� | |
���Ѵ� | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | ��103 | 83 | ������ˮ |
(1)�Ʊ���Ʒ��12.5mL���Ѵ������Թ�A�У��ټ���1mlŨ���ᣬҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
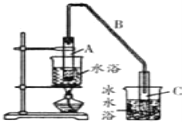
��A�����Ƭ��������_____________������B���˵�������е�������_______��
��д�����Ѵ��Ʊ�����ϩ�Ļ�ѧ��Ӧ����ʽ___________________________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����____________________________��
(2)����ϩ��Ʒ�к��л��Ѵ��������������ʵ���Ҫ�ᴿ��
�ټ��뱥��ʳ��ˮ�������á��ֲ㣬ˮ��_______�㣨���ϻ��£�����Һ����_________�������ţ�ϴ�ӡ�
a��KMnO4��Һ b��ϡ H2SO4 c��Na2CO3��Һ
���ٽ�����ϩ��������ʱҪ������ʯ�ң�Ŀ����_____________________________��
���ռ���Ʒʱ�����Ƶ��¶�Ӧ��_________���ҡ�
(3)�������ֻ���ϩ��Ʒ�ʹ�Ʒ�ķ�������������_______��
a�������Ը��������Һ b���ý����� c����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������ȡSO2����֤SO2��ijЩ���ʵ�װ��(�г�װ�úͼ���װ�����ԣ��������Ѽ���)����ش��������⣺
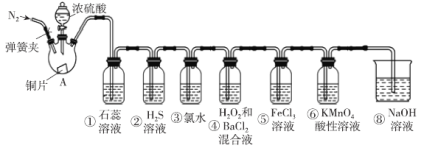
��1����A�з�����Ӧ�Ļ�ѧ����ʽΪ___��
��2�����е�ʵ������Ϊ��ɫʯ����Һ___��
���е�ʵ������Ϊ___��д���˻�ѧ��Ӧ����ʽ___��
���е�ʵ��������___��д���˻�ѧ��Ӧ����ʽ___��
���е�ʵ��������___��д���˻�ѧ��Ӧ����ʽ___��
���е���������Һ�ɻ�ɫ��Ϊdz��ɫ���䷴Ӧ�����ӷ���ʽΪ___��
��3�������ֳ�SO2��ԭ�Ե�ʵ�������___��
��4��ʵ���������Ҫͨ��N2����Ŀ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ɽ���Ԫ�����ճ��������й㷺��Ӧ�á�
��1���������ڲ��Ͽ�ѧ������Ҫ���ã�����Ϊ���Ͻ��ά���ء�����̬��ԭ�ӵļ۲���ӵ��Ų�ʽΪ__����̬Niԭ�Ӻ�����__���˶�״̬��ͬ�ĵ��ӣ�M��ĵ�������__�ֲ�ͬ����չ����
��2����������Ԫ�صĵ�һ��������ԭ������������������������ģ���Se�ĵ�һ�����ܵ���As��ԭ����___��
��3��NO2-�������γɵ�������[Co(NO2)6]3-�����ڼ���K+�Ĵ��ڡ����������÷���![]() ��ʾ������m���������γɴ�������ԭ������nΪ��ԭ�ӵĵ����������γ������ĵ��ӳ��⣩�͵õ��������ܺͣ��籽�����еĴ������ɱ�ʾΪ
��ʾ������m���������γɴ�������ԭ������nΪ��ԭ�ӵĵ����������γ������ĵ��ӳ��⣩�͵õ��������ܺͣ��籽�����еĴ������ɱ�ʾΪ![]() ����NO2-�д�����Ӧ��ʾΪ__��
����NO2-�д�����Ӧ��ʾΪ__��
��4��Mn3+��ˮ��Һ�������绯ΪMnO2��Mn2+������˵����������___��
A.Mn3+�ļ۵��ӹ���Ϊ3d4�������ڽ��ȶ��ĵ��ӹ���
B.����Mn2+�ĵ��ӹ��Ϳ�֪��Mn2+�в����ɶԵ���
C.��������Ԫ���У���ԭ�Ӽ۵��Ӳ���δ�ɶԵ��������
D.Mn2+��Fe3+������ͬ�ļ۵��ӹ��ͣ��������ǵĻ�ѧ��������
��5��FeO�����Ӿ��壬�侧���ܿ�ͨ��ͼ�е�Born��Haberѭ������õ���
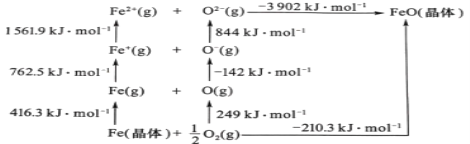
��֪��Oԭ�ӵĵ�һ��������Ϊ___kJmol-1��FeO������Ϊ___kJmol-1��
��6��ͭ�������γ���ͼ��ʾ�ľ����ṹ������Cu���ȵط�ɢ���������ڲ���a��b�������������Ϊ��0��0��0������![]() ��
��![]() ��
��![]() ������d����������Ϊ___����֪�þ�����ܶ�Ϊ��gcm-3��NA�ǰ����ӵ�������ֵ��������Ϊ___pm��
������d����������Ϊ___����֪�þ�����ܶ�Ϊ��gcm-3��NA�ǰ����ӵ�������ֵ��������Ϊ___pm��

���г�����ʽ���ɣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com