
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Ni原子核外有__种运动状态不同的电子,M层的电子云有__种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Se的第一电离能低于As,原因是___。
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO2-中大π键应表示为__。
,则NO2-中大π键应表示为__。
(4)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(5)FeO是离子晶体,其晶格能可通过图中的Born—Haber循环计算得到。
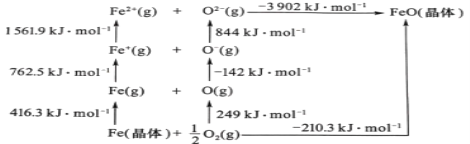
可知,O原子的第一电子亲和能为___kJmol-1,FeO晶格能为___kJmol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。
),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。

(列出计算式即可)
【答案】3d34s2 28 9 Se:[Ar]3d104s24p4、As:[Ar]3d104s24p3,半充满,能量低,稳定,难失电子,因此Se的第一电离能明显低于As ![]() A 142 3902 (
A 142 3902 (![]() ,
,![]() ,
,![]() )
) 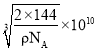
【解析】
(1)钒为23号元素,基态钒原子核外电子排布式为1s22s22p63s23p63d34s2,则其价电子排布式为3d34s2;每个电子的运动状态均不相同,基态Ni原子核外有28个电子,则有28种运动状态不同的电子,M层上能级有3s、3p、3d,则M层的电子云有9种不同的伸展方向。
(2)因为Se:[Ar]3d104s24p4、As:[Ar]3d104s24p3,半充满,能量低,稳定,难失电子,因此Se的第一电离能明显低于As。
(3)NO2-中参与形成大π键的原子数为3,则m=3,各原子的单电子数为3,得电子数为1,故n=4,可用符号![]() 表示NO2-中大π键。
表示NO2-中大π键。
(4)A.Mn3+的价电子构型为3d4,Mn3+在水溶液中容易歧化为MnO2和Mn2+,说明Mn3+不稳定,Mn3+易变成电子半充满的稳定电子构型,故3d4不属于较稳定的电子构型,A正确;
B.根据Mn2+的电子构型可知,Mn2+中价电子层不含成对电子,但内层中含有成对电子,B错误;
C.第四周期元素中价电子层中未成对电子数最多的元素价电子排布式为3d54s1,为铬元素,C错误;
D.Mn2+与Fe3+具有相同的价电子构型,微粒的化学性质不仅与价电子构型有关,也和微粒的电荷数、半径等有关,故它们的化学性质不相似,D错误;
答案选A。
(5)第一亲和能为气态基态原子获得一个电子变成气态一价负离子放出的能量,根据图示可知,O原子的第一电子亲和能为142kJmol-1;晶格能是指气态离子形成1mol离子晶体所释放的能量,故FeO晶格能为3902kJmol-1。
(6)d点在体对角线的四分之一处,与a点相对的位置,因此可以得到d点坐标参数为(![]() ,
,![]() ,
,![]() ),铜原子位于晶胞体内,个数为4,氧原子位于晶胞的顶点和体内,个数为
),铜原子位于晶胞体内,个数为4,氧原子位于晶胞的顶点和体内,个数为![]() ,故化学式为Cu2O,根据体积公式
,故化学式为Cu2O,根据体积公式 ,则晶胞的参数为
,则晶胞的参数为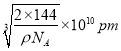 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图2所示。B的价电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的ds区,其基态原子不存在不成对电子。B与C所形成化合物晶体的晶胞如图3所示。
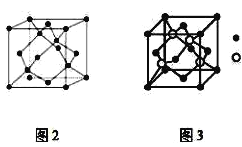
(1)A单质晶体属于__晶体(填晶体类型)。其原子杂化方式为__。
(2)B与C所形成化合物晶体的化学式__。
(3)B与C所形成化合物晶体的密度为ag/cm3,则B原子之间最近距离为__cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.标准状况下,2.24LCH4中所含碳氢键的数目为0.4NA
B.1mol重水与1mol水中,中子数比为2:1
C.5.6g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为0.4NA
D.标准状况下,11.2L二氧化碳与和足量的过氧化钠反应,转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,工作一段时间后,在两极区均得到副产品NH4NO3。下列叙述错误的是( )
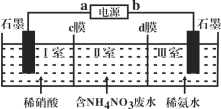
A.a极为电源负极,b极为电源正极
B.c膜是阳离子交换膜,d膜是阴离子交换膜
C.阳极电极反应式为4OH--4e-=O2↑+2H2O
D.Ⅱ室溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为 和
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:

这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为 ;第二步反应的离子方程式为 。
(3)工业煤干馏得到的产品有焦炭、 、 等。
(4)湿式石灰石—石膏法脱硫工艺是烟气脱硫技术中最成熟的一种方法。其工艺流程是:烟气经锅炉预热器出来,进入电除尘器除掉大部分粉煤灰烟尘,再经过一个专门的热交换器,然后进入吸收塔,烟气中的SO2与含有石灰石的浆液进行气液接触,通入空气后生成石膏,经脱硫的烟气,应用循环气体加热器进行再加热,进入烟囱,排入大气。
①写出湿法石灰石—石膏法脱硫所涉及的化学反应方程式:______________________。
②用石灰石浆液作SO2吸收剂而不用熟石灰吸收SO2的原因是:_________________________
③上述过程中得到的石膏,如果含氯化合物(主要来源于燃料煤)超过杂质极限值,则石膏产品性能变坏。工业上消除可溶性氯化物的方法是____________________________________ 。
(5)某化学兴趣小组为了测定烟气脱硫所得石膏的组成(CaSO4·xH2O)即测定x值,做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如图所示。数据表明当固体的质量为2.72g后不再改变。①石膏的化学式为_______________。②图像中AB段对应化合物的化学式为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的中心原子的杂化杂化类型为__。基态P原子核外电子占据最高能级的电子云轮廓图为__。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸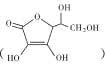 常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
(3)Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是___(填标号)。
A.![]() B.
B. C.
C.![]() D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列有机化合物:
A. B.
B. 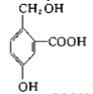 C.
C. 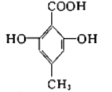 D.
D.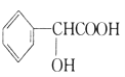 E.CH2=CHCOOCH=CHCOOCH=CH2
E.CH2=CHCOOCH=CHCOOCH=CH2
(1)可以看作醇类的是__________(填字母,下同)。
(2)可以看作酚类的是__________。
(3)可以看作羧酸类的是__________。
(4)可以看作酯类的是__________。
(5)有机物A中含有的官能团有_________种(填数字)。
(6)有机物C中含有的官能团有__________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚天津港危化品发生爆炸,造成重大财产损失和人员伤亡。据报道爆炸点库存大量硝酸铵、硝酸钾、氰化钠(NaCN)、金属钠和镁等化学品。下列说法错误的是( )
A. 硝酸铵本身具有氧化还原性,受热或撞击易发生爆炸
B. 氰化钠属剧毒物质,用过氧化氢处理氰化钠现场和水污染的离子方程式:2CN-+5H2O2===2HCO![]() +N2↑+4H2O
+N2↑+4H2O
C. 爆炸发生引发大火,用大量水灭火
D. 硝酸盐等氧化性物质不能与还原性物质如钠、镁、有机化合物等存放在一起
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com