
【题目】1L稀硝酸和稀硫酸的混合溶液中,硝酸和硫酸的物质的量浓度均为![]() 。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
。若向混合液中加入足量的铜粉,则最多能溶解铜粉的质量为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验),请回答下列问题:
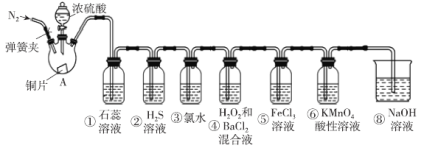
(1)在A中发生反应的化学方程式为___。
(2)①中的实验现象为紫色石蕊溶液___。
②中的实验现象为___,写出此化学反应方程式___。
③中的实验现象是___,写出此化学反应方程式___。
④中的实验现象是___,写出此化学反应方程式___。
⑤中的现象是溶液由黄色变为浅绿色,其反应的离子方程式为___。
(3)能体现出SO2还原性的实验序号是___。
(4)实验结束后需要通入N2,其目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Ni原子核外有__种运动状态不同的电子,M层的电子云有__种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Se的第一电离能低于As,原因是___。
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO2-中大π键应表示为__。
,则NO2-中大π键应表示为__。
(4)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(5)FeO是离子晶体,其晶格能可通过图中的Born—Haber循环计算得到。
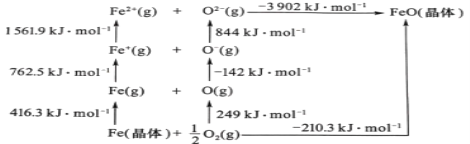
可知,O原子的第一电子亲和能为___kJmol-1,FeO晶格能为___kJmol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。
),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。

(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)根据题意选择以下四种物质的字母序号填空
A:Si B:Na2SiO3 C:Ca(ClO)2 D:KAl(SO4)2·12H2O
①漂白粉的有效成分是___。
②可用于制备硅胶和木材防火剂的是___。
③可用于制计算机芯片的是___。
④可用于作净水剂的是___。
(2)8.4gNaHCO3正好与20mL盐酸完全反应。此盐酸的物质的量浓度是___,产生的CO2在标准状况下的体积是___L。
(3)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①请用“单线桥”标明该反应电子转移的方向与数目___。
②该反应中氧化剂是___;当有1molNa2FeO4生成,转移的电子有___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炽热的炉膛内有反应:![]() 往炉膛内通入水蒸气时,有如下反应:
往炉膛内通入水蒸气时,有如下反应:![]() ,
,![]() ,
,![]() ,其能量变化示意图如下,
,其能量变化示意图如下,

已知CO的燃烧热为![]() 。下列有关说法正确的是
。下列有关说法正确的是![]()
A.![]()
B.![]() 的燃烧热为
的燃烧热为![]()
C.在反应![]() 中,反应物总键能大于生成物总键能
中,反应物总键能大于生成物总键能
D.往炽热的炉膛内通入水蒸气可节省燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 已知:
已知:![]()
![]() ;
;![]() ,根据上述信息,写出C转化为CO的热化学方程式_________________________________________。
,根据上述信息,写出C转化为CO的热化学方程式_________________________________________。
![]() 已知热化学方程式:
已知热化学方程式:![]()
![]() ,该反应的活化能为
,该反应的活化能为![]() ,则其逆反应的活化能为___________
,则其逆反应的活化能为___________![]()
![]() 用
用![]() 催化还原
催化还原![]() 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
![]()
![]()
![]()
![]()
若用标准状况下![]() 还原
还原![]() 生成
生成![]() ,反应中转移的电子总数为_______
,反应中转移的电子总数为_______![]() 用阿伏加德罗常数
用阿伏加德罗常数![]() 表示
表示![]() ,放出的热量为_______kJ。
,放出的热量为_______kJ。
![]() 已知
已知![]() ;
;![]() 。蒸发1mol
。蒸发1mol![]() 需要吸收的能量为30J,其它相关数据如下表,则表中 a为__________________
需要吸收的能量为30J,其它相关数据如下表,则表中 a为__________________
|
|
|
|
1mol分子中的化学键断裂时 需要吸收的能量 | 436 | a | 369 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铝广泛应用在显像管生产,稀土的提炼等,工业上具体流程如下:
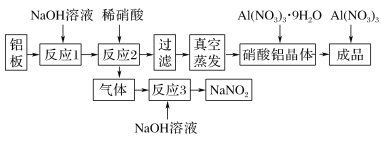
已知:①硝酸铝白色透明结晶。易溶于水和乙醇,极微溶于丙酮,几乎不溶于乙酸乙酯。
②熔点73℃,在135℃时分解。
③硝酸和铝反应的还原产物分布如图1。
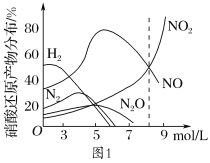
某兴趣小组在实验室制取硝酸铝,请回答:
(1)从工业生产角度考虑稀硝酸的最佳浓度范围为________ mol·L-1。反应2中的离子方程式____________。
(2)下列说法合理的是________。
A 反应1中加入的NaOH溶液,除油污和氧化膜,所以要足量
B 没有真空,也可在水浴条件下蒸发,防止Al(NO3)3的分解
C Al(NO3)3·9H2O干燥时,可放在如图2的干燥器中,隔板下放上浓硫酸吸水,由于吸附力较大,要用力垂直拉开玻璃盖
D 制取后的Al(NO3)3必须密封保存
(3)Al(NO3)3·9H2O也可以和SOCl2反应,除了生成Al(NO3)3,其它产物都是酸性气体,有关的方程式是______________;
(4)由铝制备Al(NO3)3的装置如图3:
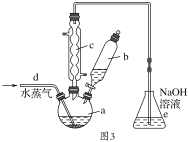
①通入水蒸气的作用是提高温度和________。
②e中很难除尽尾气,理由是_______________, Al(NO3)3·9H2O晶体吸附HNO3,合适的洗涤剂是________。
③有人认为C的冷凝管是多余的,他提供的理由可能是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com