
����Ŀ���������㷺Ӧ���������������ϡ���������ȣ���ҵ�Ͼ����������£�
��֪������������ɫ���ᾧ��������ˮ���Ҵ��������ڱ�ͪ����������������������
���۵�73�棬��135��ʱ�ֽ⡣
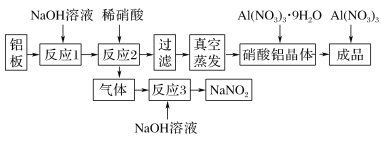
�����������Ӧ�Ļ�ԭ����ֲ���ͼ1��
ij��ȤС����ʵ������ȡ����������ش�
��1���ӹ�ҵ�����Ƕȿ���ϡ��������Ũ�ȷ�ΧΪ________ mol��L��1����Ӧ2�е����ӷ���ʽ____________��
��2������˵����������________��
A ��Ӧ1�м����NaOH��Һ�������ۺ�����Ĥ������Ҫ����
B û����գ�Ҳ����ˮԡ��������������ֹAl(NO3)3�ķֽ�
C Al��NO3��3��9H2O����ʱ���ɷ�����ͼ2�ĸ������У������·���Ũ������ˮ�������������ϴ�Ҫ������ֱ����������
D ��ȡ���Al(NO3)3�����ܷⱣ��
��3��Al(NO3)3��9H2OҲ���Ժ�SOCl2��Ӧ����������Al(NO3)3���������ﶼ���������壬�йصķ���ʽ��______________��
��4�������Ʊ�Al(NO3)3��װ����ͼ3��
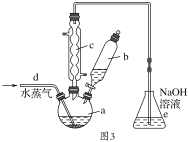
��ͨ��ˮ����������������¶Ⱥ�________��
��e�к��ѳ���β����������_______________�� Al(NO3)3��9H2O��������HNO3�����ʵ�ϴ�Ӽ���________��
��������ΪC���������Ƕ���ģ����ṩ�����ɿ�����___________��
���𰸡�8��8.5 4Al��18H����6NO3-=4Al3����3NO����3NO2����9H2O D Al(NO3)3��9H2O��9SOCl2=Al(NO3)3��9SO2����18HCl�� ���� ����HNO3�ڷ�Ӧ������Ũ�Ȳ��ϱ仯��NO��NO2���ʵ���֮�Ȳ�һ����1��1 ��ˮ ͨ���ˮ����������������ʹŨ��Ѹ���½�����Ӧ����Ѹ�ٱ�С
��������
��1���ڷ�Ӧ�����У���Ӧ�����Ļ�����Ⱦ����ΪNO��NO2��N2O��Ϊ���ٶԻ�������Ⱦ���ӷ�Ӧ����ʽNO��NO2��2NaOH==2NaNO2��ȷ��NO��NO2�������ϵ���Ӷ���ͼ���ҵ�ϡ��������Ũ�ȷ�Χ����Ӧ�ķ�Ӧ2�У�ȷ��NO��NO2�������ϵ��Ҳ��ȷ�������ʵ�����ϵ���Ӷ�ȷ����ԭ���P��Թ�ϵ��Ҳ����д����Ӧ�����ӷ���ʽ��
��2��A.NaOH��Һ������ȥ�����ۺ�����Ĥ��Ҳ����Al��Ӧ��
B.û����գ�Ҳ����ˮԡ���������������ڷ�ֹAl(NO3)3�ֽ��ͬʱ��ҲҪ��ֹˮ�ⷴӦ�ķ�����
C.������������һ��Ź轺��ˮ��Ũ������ˮ����̫ǿ���ᵼ�¾���ʧȥ���еĽᾧˮ��
D.��ȡ���Al(NO3)3����ˮ�������ܷⱣ�档
��3���˷�Ӧʵ����ˮ��SOCl2��Ӧ���ӻ��ϼۿ��ǣ�ֻ������SO2��HCl��
��4����ͨ��ˮ��������������¶Ȼ�����������ϡ����Ӵ���������ã�
��NO��NO2�����ʵ���֮�Ȳ�һ����1��1��
Al(NO3)3��9H2O��������HNO3�������л���л��ﲻ�ܳ�ȥ������HNO3��
�۴ӷ����������Ƕ���ķ����ǣ�ͨ���ˮ����������������ʹŨ��Ѹ���½���
��1�������������Ӧ�Ļ�ԭ����ֲ�ͼ��������8��8.5 mo l��L��1ʱ��NO��NO2��1��1�������ױ�NaOH���գ���Ӧ�ķ���ʽΪNO��NO2��2NaOH===2NaNO2����Ӧ�ķ�Ӧ2�����ӷ���ʽ��4Al��18H����6NO![]() ==4Al3����3NO����3NO2����9H2O����Ϊ��8��8.5��4Al��18H����6NO3-=4Al3����3NO����3NO2����9H2O��
==4Al3����3NO����3NO2����9H2O������8��8.5��4Al��18H����6NO3-=4Al3����3NO����3NO2����9H2O��
��2��A.NaOH��Һ�������ۺ�����Ĥ��ҲҪ��Al��Ӧ������Ӧ������A����ȷ��
B.û����գ�Ҳ����ˮԡ��������������Ҫ��ֹAl(NO3)3�ķֽ⣬ҲҪ��ֹ����ˮ�⣬B����ȷ��
C.������������һ��Ź轺��ˮ����ʱ��Ҫ����ƽ�Ʋ����ǣ�C����ȷ��
D.��ȡ���Al(NO3)3�����ܷⱣ�棬��ˮ�⣬D��ȷ����Ϊ��D��
��3���˷�Ӧʵ����ˮ��SOCl2��Ӧ���ӻ��ϼۿ��ǣ�ֻ������SO2��HCl����Ӧ�ķ���ʽΪAl(NO3)3��9H2O��9SOCl2=Al(NO3)3��9SO2����18HCl������Ϊ��Al(NO3)3��9H2O��9SOCl2=Al(NO3)3��9SO2����18HCl����
��4����ͨ��ˮ��������������¶Ȼ��������ã���Ϊ�����裻
������ˮ����ͨ��ͷ�Ӧ��HNO3��Ũ�Ȳ��ϱ仯��NO��NO2�����ʵ���֮�Ȳ���1��1�����ѱ�NaOH���ոɾ�����Ϊ������HNO3�ڷ�Ӧ������Ũ�Ȳ��ϱ仯��NO��NO2���ʵ���֮�Ȳ�һ����1��1��
Al(NO3)3��9H2O��������HNO3�����ʵ�ϴ�Ӽ�����ˮ�������л���л��ﲻ�ܳ�ȥ������HNO3����Ϊ����ˮ��
�۴ӷ����������Ƕ���ķ����ǣ�ͨ��ˮ����������������ʹŨ��Ѹ���½�����Ӧ����Ѹ�ٱ�С����Ϊ��ͨ��ˮ����������������ʹŨ��Ѹ���½�����Ӧ����Ѹ�ٱ�С��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1Lϡ�����ϡ����Ļ����Һ�У��������������ʵ���Ũ�Ⱦ�Ϊ![]() ��������Һ�м���������ͭ�ۣ���������ܽ�ͭ�۵�����Ϊ
��������Һ�м���������ͭ�ۣ���������ܽ�ͭ�۵�����Ϊ
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��8��12��������Σ��Ʒ������ը������ش�Ʋ���ʧ����Ա�������ݱ�����ը�����������李�����ء��軯��(NaCN)�������ƺ�þ�Ȼ�ѧƷ������˵���������(����)
A. ����隣�������������ԭ�ԣ����Ȼ�ײ��������ը
B. �軯�����綾���ʣ��ù���������軯���ֳ���ˮ��Ⱦ�����ӷ���ʽ��2CN����5H2O2===2HCO![]() ��N2����4H2O
��N2����4H2O
C. ��ը������������ô���ˮ���
D. �����ε����������ʲ����뻹ԭ���������ơ�þ���л�������ȴ����һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ��ʾ��ͼ����ͼ��ʾ������˵���У���ȷ���ǣ� ��

A. ȼ�ϵ�ع���ʱ��������ӦΪ��O2 + 2H2O + 4e���� 4OH��
B. a��������b����ͭʱ��b�����ܽ⣬a������ͭ����
C. a���Ǵ�ͭ��b���Ǵ�ͭʱ��a�����ܽ⣬b������ͭ����
D. a��b��������ʯīʱ������ͬ������a���������������������ĵ�H2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC(s)+H2O(g)![]() CO(g)+H2(g)��һ���ݻ����ܱ������н��У�������˵��������У��ܹ���������( )
CO(g)+H2(g)��һ���ݻ����ܱ������н��У�������˵��������У��ܹ���������( )
A. ��������������������������Сһ�룬��Ӧ���ʼ�С
B. ����������䣬��������He����ʹ��ϵѹǿ����Ӧ����һ������
C. ��Ӧ��ƽ��״̬ʱ��v(CO)��=v(H2O)��
D. �����������䣬�ʵ�����C(s)��������ʹ��Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ���ܺ���Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵������ȷ���ǣ�������

A. ԭ��Һһ������CO32����SO42����һ��������Fe3+
B. ԭ��Һһ������Cl�������ܴ���Na+
C. ԭ��Һ��c��Cl������0.1molL��1
D. ��ԭ��Һ�в�����Na+����c��Cl������0.1molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ���绯ѧװ�õ�ʾ��ͼ��
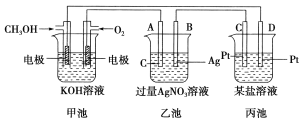
��ش��������⣺
��1��ͼ�м׳���________(�ԭ��ء��������ء���Ƴء�)��
��2��A(ʯī)�缫��������________(�����������������������������������)��
��3��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ��_________________________________��
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ______________________________________��
��5�����ҳ���B(Ag)����������5.4 gʱ���׳�������������O2�����Ϊ________L(��״��)����ʱ������ij�缫����1.6 gij������������е�ij����Һ������________(����ĸ)��
A�� MgSO4 B��CuSO4 C�� NaCl D�� AgNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2��H2Ϊԭ�Ϻϳ���ϩ�ķ���ʽΪ��2CO2��g����6H2��g��![]() C2H4��g����4H2O��g������H���ڳ�ѹ�£���n��CO2����n��H2����1��3�������ʵ���Ϊ4a mol����Ͷ�ϱȳ����ܱ������з�����Ӧ������¶ȶ�CO2��ƽ��ת���ʺʹ�����Ч��Ӱ���������ͼ��ʾ��
C2H4��g����4H2O��g������H���ڳ�ѹ�£���n��CO2����n��H2����1��3�������ʵ���Ϊ4a mol����Ͷ�ϱȳ����ܱ������з�����Ӧ������¶ȶ�CO2��ƽ��ת���ʺʹ�����Ч��Ӱ���������ͼ��ʾ��
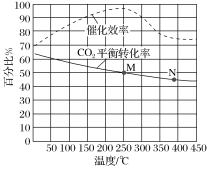
������˵������ȷ����________��
A ��H<0��ƽ�ⳣ����KM��KN
B ������������������ܼӿ췴Ӧ���ʣ�����Ӱ��ƽ��ת����
C ��Ͷ�ϱȸ�Ϊn��CO2����n��H2����3��1���������CO2��ƽ��ת����
D 250 ��ʱ����Ч����ߣ���������ѷ�Ӧ�¶�
��250 ���£�������Ӧ��ƽ��ʱ�������ΪV L������¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ________���ú�a��V�Ĵ���ʽ��ʾ����
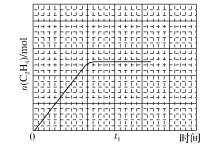
��ij�¶��£�n��C2H4����ʱ�䣨t���ı仯����������ͼ��ʾ������������ͬʱ�������������Ϊ��һ�룬����0��t1ʱ��n��C2H4����ʱ�䣨t���ı仯��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500��600������м��ͨ������������ˮ�Ȼ�����������ͼ��ʾ��װ�ý���ʵ�飬����˵����ȷ����

A.��Һ©����ʢ�ŵ��Լ���ϡ����
B.ϴ��ƿ��ʢ�ŵ��Լ��DZ���ʳ��ˮ
C.Ӧ�ȵ�ȼI�оƾ��ƣ��ٵ�ȼIII�оƾ���
D.�ձ���ʢ��ʯ��ˮ��Ŀ��������β��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com