
【题目】如图所示是一个电化学装置的示意图。
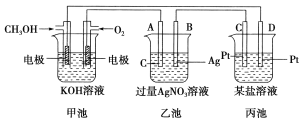
请回答下列问题:
(1)图中甲池是________(填“原电池”、“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”、“负极”、“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_________________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极质量增加5.4 g时,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________(填字母)。
A. MgSO4 B.CuSO4 C. NaCl D. AgNO3
【答案】(1)原电池(2) 阳极(3)CH3OH+8OH--6e-===CO+6H2O
(4)4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3(5)0.28 B
4Ag+O2↑+4HNO3(5)0.28 B
【解析】
试题分析:(1)甲池甲醇与氧气能自发的进行氧化还原反应,形成燃料电池,所以属于原电池。
(2)A与甲池中氧气一极相连,燃料电池中氧气是正极,故A是阳极。
(3)燃料电池中,负极上通入燃料,碱性条件下,甲醇水中和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O。
(4)乙池是电解池,碳作阳极,银作阴极,所以反应是电解硝酸银溶液,电池反应式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3。
4Ag+O2↑+4HNO3。
(5)乙池是电解池,B极上银离子得电子发生还原反应而析出银,根据转移电子相等,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积=[(5.4/108)/4]×22.4L/mol=0.28L;丙池是电解池,阴极上金属离子放电析出金属单质,则金属元素在氢元素之后,D电极连接甲醇电极,所以D是阴极,根据转移电子相等知,当析出一价金属时,其摩尔质量=1.6/5.4/108=32g/mol,则该元素是硫元素,硫元素是非金属元素,所以错误,当析出的是二价金属,则1.6/5.4/108/2=64g/mol,所以该金属是铜,则溶液是硫酸铜溶液,故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。化合物有E最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯.玉米淀粉等发酵制得,E的钙盐是人们喜爱的补钙剂之一。
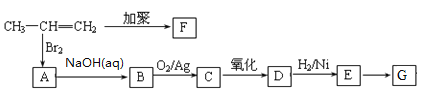
已知:![]()
(1)D中所含官能团名称。E→G的反应类型为_________。
(2)聚合物F的结构简式。聚合物G的结构简式_________
(3)在一定条件下,两分子E在浓硫酸作用下形成一种六元环状化合物,该化合物的结构简式是_________。
(4)B转化为C的化学反应方程式是_________。
(5)下列四种化合物与E互为同分异构体的是_________。
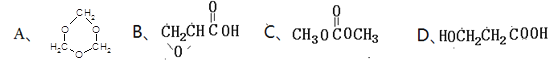
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用如图所示装置制备1,2﹣二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液。试管d中装有浓溴水(表面覆盖少量水)。
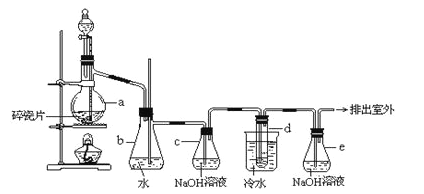
请填写下列空白:
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易发生副反应.请写出乙醇发生消去反应的方程式 。
(2)写出制备1,2﹣二溴乙烷的化学方程式: 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请回答发生堵塞时瓶b中的现象: 。
(4)容器c中NaOH溶液的作用是: 。
(5)判断该制备反应已经结束的最简单方法是___________________________;
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置d,其主要目的是___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,合成氨反应:N2(g)+3H2(g)![]() 2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
2NH3(g),生成2 mol NH3放出92.4 kJ热量。在该温度下,取1 mol N2(g)和3 mol H2(g)在体积为2L的密闭容器中充分反应,放出的热量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
如果反应5分钟达到平衡时气体总物质的量为2.5mol,则这段时间内氢气的反应速率为 ,达平衡时氮气的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
![]()
![]()
![]()
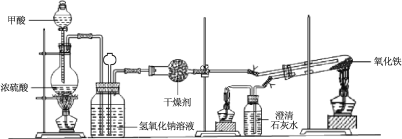
① 按上图连接好装置,检查装置气密性。
② 称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③ 在完成某项操作后,点燃另外两处酒精灯。
④ 30 min后熄灭酒精灯,关闭弹簧夹。
⑤ 待产物冷却至室温后,收集产物。
⑥ 采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数%[§科§网] | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____。(要求保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳的氧化物直接合成乙醇燃料已进入大规模生产。
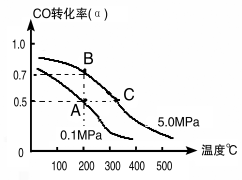
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
已知:2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
H2O(g)===H2O(l) △H4=-44kJ·mol-1
①△H= kJ·mol-1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tA tC(填“﹥”、“﹤”或“﹦”)。
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极上CO反应的电极反应式为 。
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(3)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)将标准状况下4.48L CO2通入1L 0.3mol·L-1 NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2化学与技术】
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。
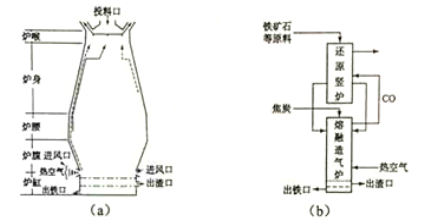
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2 和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的
部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2 污染空气,脱SO2 的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)硫酸铁铵[NH4Fe(SO4)2·12H2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。写出硫酸铁铵溶液中离子浓度的大小顺序 。
(2)FeSO4/KMnO4工艺与单纯混凝剂[FeCl3、Fe2(SO4)3]相比,大大降低了污水处理后水的浑浊度,显著提高了对污水中有机物的去除率。二者的引入并未增加沉降后水中总铁和总锰浓度,反而使二者的浓度降低,原因是在此条件下(pH约为7)KMnO4可将水中Fe2+、Mn2+氧化为固相的+3价铁和+4价锰的化合物,进而通过沉淀、过滤等工艺将铁、锰除去。已知:Ksp(Fe(OH)3=4.0×10-38,则沉淀过滤后溶液中c(Fe3+)约为 mol·L-1。写出生成+4价固体锰化合物的反应的离子方程式 。
(3)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如图:
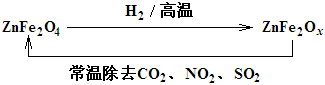
用ZnFe2Ox除去SO2的过程中,氧化剂是 。(填化学式)
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。先通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO+H2S=2[Fe(CN)6]4-+2HCO+S↓。电解时,阳极的电极反应式为 ;电解过程中阴极区溶液的pH (填“变大”、“变小”或“不变”)。
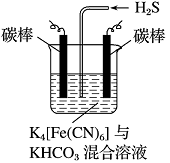
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质谱图表明某有机物的相对分子质量为70,红外光谱表明有C==C和C==O的存在,1H核磁共振谱如下图(峰面积之比依次为1:1:1:3):分析核磁共振谱图,回答下列问题:
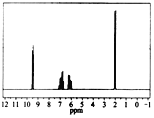
(1)分子中共有 种化学环境不同的氢原子。
(2)该物质的分子式为 。
(3)该有机物的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com