
【题目】由碳的氧化物直接合成乙醇燃料已进入大规模生产。
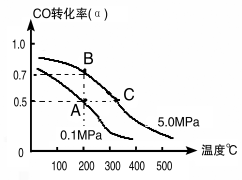
(1)如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g) △H;若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇,CO的转化率(α)与温度、压强的关系如下图所示。
已知:2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
H2O(g)===H2O(l) △H4=-44kJ·mol-1
①△H= kJ·mol-1
②若A、C两点都表示达到的平衡状态,则从反应开始到达平衡状态所需的时间tA tC(填“﹥”、“﹤”或“﹦”)。
③若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
④熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极上CO反应的电极反应式为 。
(2)工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
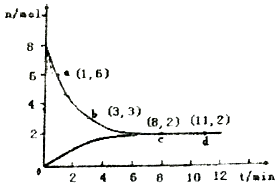
(3)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(4)将标准状况下4.48L CO2通入1L 0.3mol·L-1 NaOH溶液中完全反应,所得溶液中微粒浓度关系正确的是
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
【答案】(1)①-168 ②﹥ ③0.25L4·mol-4(单位可不写)④CO-2e-+CO32-===2CO2
(2)原料易得、原料无污染、可以减轻温室效应等
(3) 升高温度,增大压强(4)CD
升高温度,增大压强(4)CD
【解析】
试题分析:
(1)①已知:①2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
③CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
④H2O(g)===H2O(l) △H4=-44kJ·mol-1
根据盖斯定律:⑴+⑵×2-⑷×4-⑶可得2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
△H=-168kJ·mol-1
②根据图像可知,C点温度和压强均大于A点温度和压强,所以C点反应速率快,达到平衡的时间少。
③ 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
起始浓度(mol/L) 1 2 0 0
转化浓度(mol/L)0.5 1.0 0.25 0.25
平衡浓度(mol/L)0.5 1.0 0.25 0.25
根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该温度下反应的平衡常数K=![]() =0.25。
=0.25。
④CO、H2具有还原性,在负极上发生氧化反应生成CO2和H2O,电极反应式为:CO-2e-+CO32-═2CO2;H2-2e-+CO32-═CO2+H2O;
(2)由于空气中CO2的含量逐渐增大,所以该方法的优点是原料易得、可以减轻温室效应。
(3)①根据图像可知平衡时氢气的物质的量是2mol,消耗氢气的物质的量是8mol-2mol=6mol,所以根据方程式可知平衡时生成甲醇的物质的量是2mol,因此图像可表示为见答案。
②曲线I与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量增加,说明平衡向逆反应方向移动。由于正方应是体积减小的可逆反应,所以改变的条件只能是升高温度,即正方应是放热反应;曲线Ⅱ与原曲线相比达到平衡的时间减少,说明反应速率快。而平衡时氢气的物质的量减少,这说明平衡向正反应方向移动。由于正方应是体积减小的放热的可逆反应,所以改变的条件只能是增大压强。
(4)二氧化碳有0.2mol,NaOH为0.3mol,反应后生成等量的碳酸钠和碳酸氢钠。A项D项为物料守恒,根据C原子和Na原子量的关系可知D项正确,A项错误,C项为电荷守恒,正确。电荷守恒和物料守恒相加可得抵消c(Na+),可知B项错误。选CD。


科目:高中化学 来源: 题型:
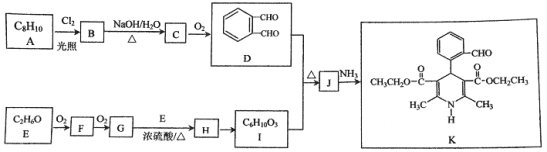
【题目】有机物K是治疗高血压药物的重要中间体,它的合成路线如下(部分转化条件略去)
已知:
Ⅰ.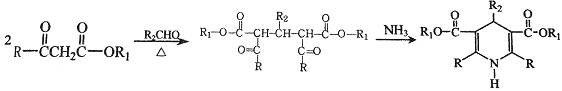
Ⅱ.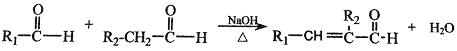 (R、R1、R2表示氢原子或烃基)
(R、R1、R2表示氢原子或烃基)
(1)A的结构简式是__________,
(2)G与E生成H的化学方程式是__________.
(3)C→D的化学方程式是__________.
(4)I的结构简式是__________。
(5)有关J的说法中,正确的是__________(选填字母).
a.能与NaHCO3反应b.能与NaOH反应c.能与新制Cu(OH)2反应
(6)K存在以下转化关系:K![]() M(C16H15NO5Na2),M的结构简式是__________。
M(C16H15NO5Na2),M的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,请根据元素①-⑧在表中的位置,用化学用语回答下列问题:
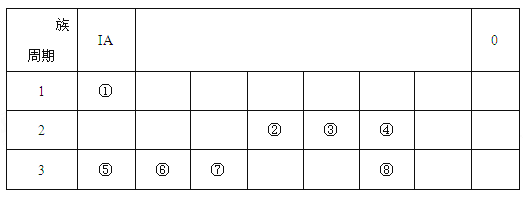
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是 (用化学式表示,下同);碱性最强的是 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是 (用离子符号表示)。
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有: 。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族) 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
![]()
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行。B的化学式为 。对应的反应①的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01molNH4Cl和0.002molNaOH溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示:
①____________
②____________
③____________。
(2)溶液中含有的微粒是__________________。
(3)在上述溶液中,电荷守恒是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个电化学装置的示意图。
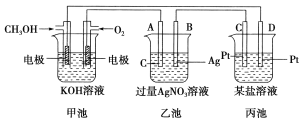
请回答下列问题:
(1)图中甲池是________(填“原电池”、“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”、“负极”、“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_________________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极质量增加5.4 g时,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________(填字母)。
A. MgSO4 B.CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
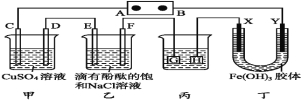
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应是 ,电镀液是 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
![]()
A. W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B. Z元素的最高价氧化物水化物的酸性强于Y
C. 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D. 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl
①该电池的负极反应式是______________;
②在电池中,Na + 不断移动到“水”电池的_______极(填“正“或“负”);
③外电路每通过4mol电子时,生成Na2 Mn5 O10 的物质的量是_______。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如下图所示:
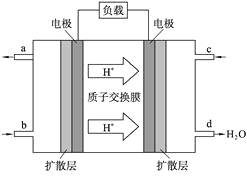
①该电池工作时,b口通入的物质为____________。
②该电池负极的电极反应式 。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,写出该电池反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。

请回答下列问题:
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为: 。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置 (填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料: 。当反应中收集到标准状况下224mL气体时,消耗的电极质量为 g。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入 极(填a或b,下同),电子从 极流出,电解质溶液中OH-向 极移动。
(4)等质量的下列物质分别完全燃烧,放出热量较多的是 (填编号)
A.固体硫, B.硫蒸气.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com