
����Ŀ��������Ԫ��W��X��Y��Z��Ԫ�����ڱ��е�λ����ͼ��ʾ������W�ĵ����ǿ�������Ҫ�ɷ֣���ѧ�����ȶ������ײμӻ�ѧ��Ӧ���������й�˵���д������
![]()
A. W��Y�����γ��ȶ��Ļ���������Ժã��������մɲ���
B. ZԪ�ص����������ˮ���������ǿ��Y
C. ����Ԫ�س������⻯�һ����YԪ���γɵ��⻯����ȶ�
D. ���⻯��WH3��HZ��Ӧ��ļ���ƿ�м���������ˮ��������Һһ�������ԡ�
���𰸡�D
�����������������W�ĵ����ǿ�������Ҫ�ɷ֣���ѧ�����ȶ������ײμӻ�ѧ��Ӧ�����W��N����X��O��Y��Si��Z��Cl��A��W��Y�����γ��ȶ��Ļ����ﵪ���裬�����Ժã��������մɲ��ϣ�A��ȷ��B����Ԫ�صķǽ�����ǿ�ڹ裬�ǽ�����Խǿ����ۺ����������Խǿ�����ZԪ�ص����������ˮ���������ǿ��Y��B��ȷ��C������Ԫ���й�ķǽ���������������γɳ������⻯�һ����SiԪ���γɵ��⻯����ȶ���C��ȷ��D�����⻯��NH3��HCl��Ӧ��ļ���ƿ�м���������ˮ��������Һ��һ�������ԣ���Ϊ�������ܹ�����D����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к˵����С��20��Ԫ��A����������������£�(I1��ʾʧȥ��1�����ӵĵ����ܣ�In��ʾԭ��ʧȥ��n�����ӵĵ����ܣ���λ����102kJ��mol��1)
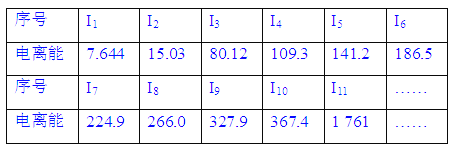
��1�����������ԽԶ������Խ�ߣ�������Խ__________(������������С��)�������ӵ����Խ�ߣ�ʧȥ����ʱ��������Խ________(������������С��)��
��2������11�����ӷ���________�����Ӳ㡣
��3��ʧȥ��11�����Ӻ�Ԫ�ػ���________�����ӡ�
��4����Ԫ������������Ӧˮ����Ļ�ѧʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298 Kʱ,�ϳɰ���Ӧ:N2(g)+3H2(g)![]() 2NH3(g),����2 mol NH3�ų�92.4 kJ�������ڸ��¶���,ȡ1 mol N2(g)��3 mol H2(g)�����Ϊ2L���ܱ������г�ַ�Ӧ,�ų������� (����ڡ������ڡ���С�ڡ�)92.4 kJ��ԭ����
2NH3(g),����2 mol NH3�ų�92.4 kJ�������ڸ��¶���,ȡ1 mol N2(g)��3 mol H2(g)�����Ϊ2L���ܱ������г�ַ�Ӧ,�ų������� (����ڡ������ڡ���С�ڡ�)92.4 kJ��ԭ����
�����Ӧ5���Ӵﵽƽ��ʱ���������ʵ���Ϊ2.5mol�������ʱ���������ķ�Ӧ����Ϊ ,��ƽ��ʱ������ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
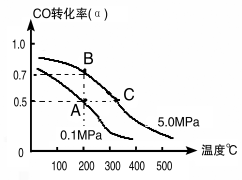
����Ŀ����̼��������ֱ�Ӻϳ��Ҵ�ȼ���ѽ�����ģ������
��1�����ȡ��CO��H2Ϊԭ�Ϻϳ���������ѧ��Ӧ����ʽ��2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ��H�����ܱ������г���10 mol CO��20mol H2���ڴ��������·�Ӧ�����Ҵ���CO��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3CH2OH(g)+H2O(g) ��H�����ܱ������г���10 mol CO��20mol H2���ڴ��������·�Ӧ�����Ҵ���CO��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
��֪��2CO(g)+O2(g)===2CO2(g) ��H1=��566kJ��mol��1
2H2(g)+O2(g)===2H2O(l) ��H2=��572kJ��mol��1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) ��H3=��1366kJ��mol��1
H2O(g)===H2O(l) ��H4=��44kJ��mol��1
����H= kJ��mol��1
����A��C���㶼��ʾ�ﵽ��ƽ��״̬�������Ӧ��ʼ����ƽ��״̬�����ʱ��tA tC�������������������������
����A��B�����ʾ��ijʱ�̴ﵽ��ƽ��״̬����ʱ��A��ʱ���������Ϊ10L������¶��µ�ƽ�ⳣ����K�� ��
������̼����ȼ�ϵ�أ�MCFS��������ú����CO+H2��������ȼ����������CO2�Ļ����Ϊ������ȼ������һ������Li2CO3��Na2CO3�����������������ʣ��Խ�������ȼ�ϼ���Ϊ�����Ƴɵġ�������CO��Ӧ�ĵ缫��ӦʽΪ ��
��2����ҵ�ϻ����Բ�ȡ��CO2��H2Ϊԭ�Ϻϳ��Ҵ������Ҹ�����ѧ�������Ƴ磬��������ͬ�����£���CO��ȡCH3CH2OH��ƽ�ⳣ��ԶԶ������CO2��ȡCH3CH2OH ��ƽ�ⳣ�������Ʋ⻯ѧ�������Ͽ���CO2��ȡCH3CH2OH���ŵ���Ҫ�ǣ� ��
��3��Ŀǰ��ҵ��Ҳ������CO2�������״���һ�������·�����ӦCO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)������6mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
CH3OH(g)��H2O(g)������6mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���

�����ڴ����ͼ�л���״������ʵ�����ʱ��仯���ߡ�
�ڽ��ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� �����ߢ��Ӧ��ʵ�������ı��� ��
��4������״����4.48L CO2ͨ��1L 0.3mol��L��1 NaOH��Һ����ȫ��Ӧ��������Һ����Ũ�ȹ�ϵ��ȷ����
A��c(Na+)=c(HCO3-)��c(CO32-)��c(H2CO3)
B��c(OH-)+c(CO32-)=c(H2CO3)��c(H+)
C��c(Na+)��c(H+)=c(HCO3-)��2c(CO32-)��c(OH-)
D��2c(Na+)=3c(HCO3-)��3c(CO32-)��3c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2��ѧ�뼼����
������Ȼ��ֲ��㷺���ڹ�ҵ��ũҵ�����Ƽ�������ҪӦ�á�
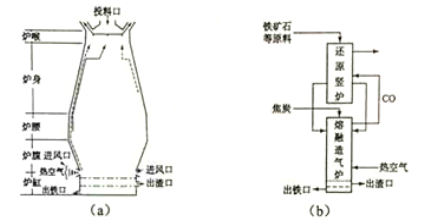
�ش��������⣺
��1��������ʯ��������ұ�������ĸ�¯��ͼ��a����ʾ��ԭ���г�����ʯ�ͽ�̿�⺬�� ����ȥ����ʯ����ʯ����Ҫ�ɷ�ΪSiO2 ���Ļ�ѧ��Ӧ����ʽΪ �� ����¯�ų��������Ҫ�ɷ���N2��CO2 �� (�ѧʽ)��
��2����֪����Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ��H=+494kJ��mol-1
��CO(g)+O2(g)=CO2(g) ��H=-283kJ��mol-1
��C(s)+O2(g)=CO(g) ��H=-110kJ��mol-1
��ӦFe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) �Ħ�H= kJ��mol-1�������Ϸ�Ӧ �ų����������Թ�����Ӧ ���������������������ʽ�����
��3��������Ƴ����������ڻ�ԭ�����������գ���������ͼ(b)��ʾ�����У���ԭ��¯�൱�ڸ�¯��
���֣���Ҫ��Ӧ�Ļ�ѧ����ʽΪ ����������¯�൱�ڸ�¯�� ���֡�
��4������ʯ�г�������ʹ��¯���л���SO2 ��Ⱦ��������SO2 �ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij���л�����ӵ����ģ��ͼ��ͼ�еġ���������������˫������ͬ��С�ġ��������ֲ�ͬ�Ķ�����Ԫ�ص�ԭ�ӡ��Ը��л���������������
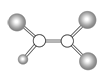
A�����л�����ܵķ���ʽΪC2HCl3
B�����л���ķ�����һ����̼̼˫��
C�����л����������ϩ���Ȼ���ӳɷ�Ӧ�õ�
D�����л�������е�����ԭ����ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ����������������������������Ҫ�����á�
��1���������[NH4Fe(SO4)2��12H2O]�㷺���ڳ�����������ˮ����ҵѭ��ˮ�ľ��������ȡ�д�����������Һ������Ũ�ȵĴ�С˳�� ��
��2��FeSO4/KMnO4�����뵥��������[FeCl3��Fe2(SO4)3]��ȣ��������ˮ������ˮ�Ļ��Ƕȣ���������˶���ˮ���л����ȥ���ʡ����ߵ����벢δ���ӳ�����ˮ������������Ũ�ȣ�����ʹ���ߵ�Ũ�Ƚ��ͣ�ԭ�����ڴ�������(pHԼΪ7)KMnO4�ɽ�ˮ��Fe2+��Mn2+����Ϊ�����+3������+4���̵Ļ��������ͨ�����������˵ȹ��ս������̳�ȥ����֪��Ksp(Fe(OH)3��4.0��10��38����������˺���Һ��c(Fe3+)ԼΪ mol��L��1��д������+4�۹����̻�����ķ�Ӧ�����ӷ���ʽ ��
��3���������ײ���ZnFe2Ox�������ڳ�ȥ��ҵ�����е�ijЩ�������ȡ�²��Ϻͳ�ȥ������ת����ϵ��ͼ��
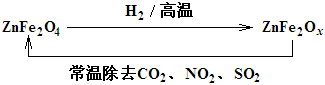
��ZnFe2Ox��ȥSO2�Ĺ����У��������� ��(�ѧʽ)
��4����ҵ�ϳ�������ͼ��ʾ���װ�ã��������Ļ����ォ��̬�������е�����ת��Ϊ�����õ�����ͨ���⣬Ȼ��ͨ��H2Sʱ������Ӧ�����ӷ���ʽΪ��2[Fe(CN)6]3����2CO��H2S��2[Fe(CN)6]4����2HCO��S�������ʱ�������ĵ缫��ӦʽΪ ������������������Һ��pH (��������С�����䡱)��
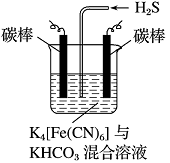
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)�ǹ�����ϵĸ�Ч�����ס����١���ȫ����ɱ��������������Ϊ����4��������������ҵ�Ͽɲ���������(NaClO3)����������(NaClO2)Ϊԭ���Ʊ�ClO2��
��1����������Ҳ��һ������������Ư��������ǿ������Һ�лᷢ���绯��Ӧ������ClO2���壬���ӷ���ʽΪ___________________________��������������Һ�м������ᣬ��Ӧ���ҡ����������Ϊ��ͬpH�����ᣬ��ʼʱ��Ӧ�������Ժ�һ��ʱ�������������Ѹ�ټӿ졣������������Ѹ�ټӿ��ԭ���� ��
��2����ѧ���ɲ��������˫��ˮ��ԭ�������Ʊ�ClO2����H2O2����ԭ���Ʊ���ClO2���ʺ���������ˮ������������Ҫԭ���� ��
��3����ⷨ��Ŀǰ�о���Ϊ���ŵ�����ClO2�ķ���֮һ����ͼ��ʾΪֱ�ӵ�������ơ��Զ���ѭ���Ʊ��ߴ�ClO2��ʵ�顣
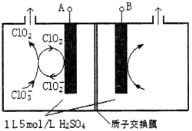
�ٵ�Դ����Ϊ___________________��(��A��B)
��д�������ҷ�����Ӧ�ĵ缫��Ӧʽ�����ӷ���ʽ
_______________________ ___ �� ��
�ۿ��Ƶ��ҺH+������5mol/L������Ч��ֹ��H+Ũ�Ƚ��Ͷ����µ�ClO2���绯��Ӧ�����������ռ�������22.4L(���������Ϊ��״�������Ե��Һ����ı仯��ClO2�����ܽ�IJ���)����ʱ��������������c(H+)֮��Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������
��1)��֪����1 mol C-H, O=O,C=O,H-O��ѧ�����������ֱ�Ϊa KJ��bKJ��cKJ��dKJ����÷�ӦCH4 + O2 = CO2 + 2H2O �ķ�Ӧ��Ϊ��H�� kJ��mol��1
��2��N2H4��һ�ָ�Ч���Ļ��ȼ�ϣ�0.25 mol N2H4(g)��ȫȼ�����ɵ�������̬ˮʱ���ų�133.5 kJ��������÷�Ӧ���Ȼ�ѧ����ʽ�� ��
![]() ��3��ijԪ�ص�һ�ֺ���X��������ΪA������N�����ӣ���ag 1HmX������������������
��3��ijԪ�ص�һ�ֺ���X��������ΪA������N�����ӣ���ag 1HmX������������������
��4���ԱȽ��������馤H�Ĵ�С(�>������<������)
A��A(g)��B(g) = C(g) ��H1<0 A(g)��B(g) = C(l) ��H2<0 ��H1____��H2
B��S(g)��O2(g) = SO2(g)��H1<0 S (s)��O2(g) = SO2(g) ��H2<0 ��H1____��H2
C��C(s)��O2(g) = CO2(g)��H1<0 C(s)��O2(g) = CO(g) ��H2<0 ��H1____��H2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com