
【题目】铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)硫酸铁铵[NH4Fe(SO4)2·12H2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。写出硫酸铁铵溶液中离子浓度的大小顺序 。
(2)FeSO4/KMnO4工艺与单纯混凝剂[FeCl3、Fe2(SO4)3]相比,大大降低了污水处理后水的浑浊度,显著提高了对污水中有机物的去除率。二者的引入并未增加沉降后水中总铁和总锰浓度,反而使二者的浓度降低,原因是在此条件下(pH约为7)KMnO4可将水中Fe2+、Mn2+氧化为固相的+3价铁和+4价锰的化合物,进而通过沉淀、过滤等工艺将铁、锰除去。已知:Ksp(Fe(OH)3=4.0×10-38,则沉淀过滤后溶液中c(Fe3+)约为 mol·L-1。写出生成+4价固体锰化合物的反应的离子方程式 。
(3)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如图:
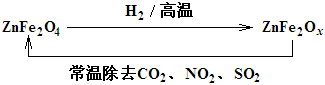
用ZnFe2Ox除去SO2的过程中,氧化剂是 。(填化学式)
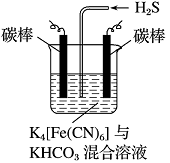
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。先通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO+H2S=2[Fe(CN)6]4-+2HCO+S↓。电解时,阳极的电极反应式为 ;电解过程中阴极区溶液的pH (填“变大”、“变小”或“不变”)。
【答案】(1)c(SO)>c(NH)>c(Fe3+)>c(H+)>c(OH-)
(2)4.0×10-17 ;3Mn2++2MnO+2H2O= 5MnO2↓+4H+
(3)①SO2 ②450 ③2∶1
(4)[Fe(CN)6]4--e-= [Fe(CN)6]3- 变大
【解析】
试题分析:
(1)硫酸铁铵[NH4Fe(SO4)2·12H2O]水解溶液显酸性,三价铁离子的水解大于铵根离子的水解,硫酸铁铵溶液中离子浓度的大小顺序为c(SO)>c(NH)>c(Fe3+)>c(H+)>c(OH-) ;
(2)沉淀过滤后溶液中c(Fe3+)约为![]() =
=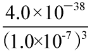 =4.0×10-17;KMnO4将Mn2+氧化为固相的+4价锰的化合物的离子方程式为3Mn2++2MnO+2H2O= 5MnO2↓+4H+;
=4.0×10-17;KMnO4将Mn2+氧化为固相的+4价锰的化合物的离子方程式为3Mn2++2MnO+2H2O= 5MnO2↓+4H+;
(3)①根据图示,ZnFe2Ox除去SO2的过程中铁元素的化合价升高,氧化剂是SO2;②ZnFe2O3中铁的化合价由+2价变成+3价,NO2中N的化合价由+4价变成0价,根据得失电子守恒,需要ZnFe2O3的物质的量为2mol,质量为2mol×225g/mol=450g;③ZnFe2O4反应后铁的化合价变成+2.5,设ZnFe2O4的物质的量为x,H2的物质的量为y,根据得失电子守恒,有[+3-(+2.5)]×2x=2y,x:y=2:1;
(4)电解时,阳极发生氧化反应,电极反应式为[Fe(CN)6]4--e-= [Fe(CN)6]3-,电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大。


科目:高中化学 来源: 题型:
【题目】下图为工业合成氨生产简易流程图:
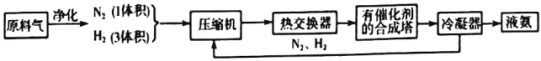
回答下列问题:
(1)合成氨所需的氮气来源于__________;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如下表:
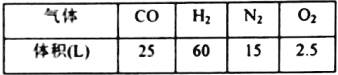
计算该富氧空气中O2和N2的体积比V(O2):V(N2)=__________。
(2)在合成氨的原料气中混有的杂质必须除去的原因是__________;
上述流程中热交换器的作用是__________。从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨。为提高原料的利用率,通常采取的措施是__________。
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快,②__________。
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):__________。
②氨基甲酸铵受热分解为尿素与水:__________。
(5)新法合成氨常采用电解法合成。即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率,新法合成氨所用的电解质能传导H+,则阴极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个电化学装置的示意图。
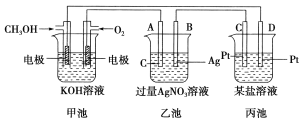
请回答下列问题:
(1)图中甲池是________(填“原电池”、“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”、“负极”、“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_________________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极质量增加5.4 g时,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________(填字母)。
A. MgSO4 B.CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
![]()
A. W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B. Z元素的最高价氧化物水化物的酸性强于Y
C. 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D. 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2 ⑦氦气
(1)这些物质中,只含共价键的是 。只含离子键的是 。既含共价键又含离子键的是 。
(2)属于离子化合物的是 。
II.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。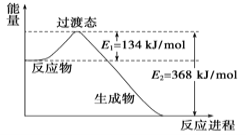
(2)已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要_____________(填“放出”或“吸收”)_____________kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl
①该电池的负极反应式是______________;
②在电池中,Na + 不断移动到“水”电池的_______极(填“正“或“负”);
③外电路每通过4mol电子时,生成Na2 Mn5 O10 的物质的量是_______。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如下图所示:
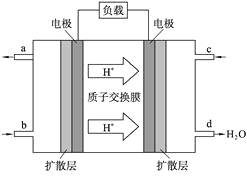
①该电池工作时,b口通入的物质为____________。
②该电池负极的电极反应式 。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,写出该电池反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应 | 化学方程式 | 焓变△H | 正反应活化能Ea |
甲烷 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
蒸汽 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
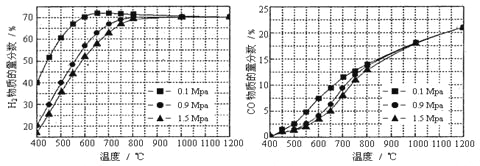
①若要达到H2物质的量分数>65%/span>、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
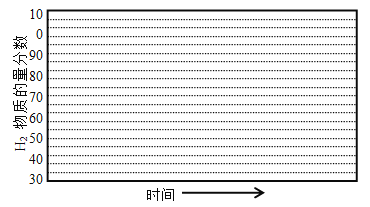
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.只用一种试剂来鉴别下列各组物质:
(1)甲醇、乙醛、乙酸,选用的试剂是 。
(2)乙酸、甲酸甲酯、乙酸乙酯,选用的试剂是 。
(3)苯、四氯化碳、1—已烯、苯酚的水溶液,选用的试剂是 。
Ⅱ.立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
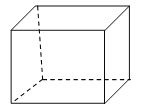
(1)“立方烷”的分子式是 ;“立方烷”有多种同分异构体,其中一种属于芳香烃的同分异构体的结构简式是 。
(2)“立方烷”的二氯代物具有同分异构体的数目是 。“立方烷”的三氯代物具有同分异构体的数目是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700 ℃,催化剂”)。G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体。
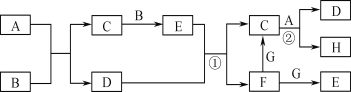
请回答下列问题:
(1)E的化学式为________________。
(2)A的电子式为________________。
(3)写出反应①的离子方程式:________________________________。
(4)写出反应②的化学方程式,并标出电子转移的方向与数目:
______________ __________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com