
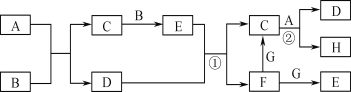
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700 ℃,催化剂”)。G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体。
请回答下列问题:
(1)E的化学式为________________。
(2)A的电子式为________________。
(3)写出反应①的离子方程式:________________________________。
(4)写出反应②的化学方程式,并标出电子转移的方向与数目:
______________ __________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)硫酸铁铵[NH4Fe(SO4)2·12H2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。写出硫酸铁铵溶液中离子浓度的大小顺序 。
(2)FeSO4/KMnO4工艺与单纯混凝剂[FeCl3、Fe2(SO4)3]相比,大大降低了污水处理后水的浑浊度,显著提高了对污水中有机物的去除率。二者的引入并未增加沉降后水中总铁和总锰浓度,反而使二者的浓度降低,原因是在此条件下(pH约为7)KMnO4可将水中Fe2+、Mn2+氧化为固相的+3价铁和+4价锰的化合物,进而通过沉淀、过滤等工艺将铁、锰除去。已知:Ksp(Fe(OH)3=4.0×10-38,则沉淀过滤后溶液中c(Fe3+)约为 mol·L-1。写出生成+4价固体锰化合物的反应的离子方程式 。
(3)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如图:
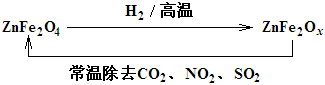
用ZnFe2Ox除去SO2的过程中,氧化剂是 。(填化学式)
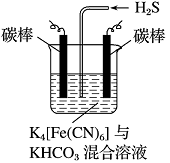
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。先通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO+H2S=2[Fe(CN)6]4-+2HCO+S↓。电解时,阳极的电极反应式为 ;电解过程中阴极区溶液的pH (填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质谱图表明某有机物的相对分子质量为70,红外光谱表明有C==C和C==O的存在,1H核磁共振谱如下图(峰面积之比依次为1:1:1:3):分析核磁共振谱图,回答下列问题:
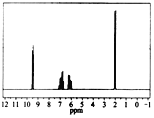
(1)分子中共有 种化学环境不同的氢原子。
(2)该物质的分子式为 。
(3)该有机物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)已知断裂1 mol C-H, O=O,C=O,H-O化学键所需能量分别为a KJ,bKJ,cKJ,dKJ,则该反应CH4 + O2 = CO2 + 2H2O 的反应热为ΔH= kJ·mol-1
(2)N2H4是一种高效清洁的火箭燃料,0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则该反应的热化学方程式是 。
![]() (3)某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是
(3)某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是
(4)试比较下列三组ΔH的大小(填“>”、“<”或“=”)
A.A(g)+B(g) = C(g) ΔH1<0 A(g)+B(g) = C(l) ΔH2<0 则ΔH1____ΔH2
B.S(g)+O2(g) = SO2(g)ΔH1<0 S (s)+O2(g) = SO2(g) ΔH2<0 则ΔH1____ΔH2
C.C(s)+O2(g) = CO2(g)ΔH1<0 C(s)+O2(g) = CO(g) ΔH2<0 则ΔH1____ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24。
(1)Z原子基态核外电子排布式为_____________。
(2)元素X与Y的第一电离能较大的__________________(填元素符号);H2Y2中Y原子轨道的杂化类型为__________。
(3)+3价Z的配合物K[Z(C2O4)2(H2O)2]中的配体是____________;与C2O42-互为等电子体的一种分子的化学式为_________。
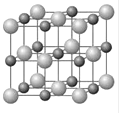
(4)Cu和Y形成的化合物的晶胞如图所示,晶胞中与铜离子距离相等且最近的铜离子有________个。某种有缺陷的铜和Y形成的化合物的晶体由Cu2+、Cu3+、Y2-及空隙组成,可表示为Cu0.98Y,则n(Cu2+)/n(Cu3+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
工业上可由A和环己烯(![]() )为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
)为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
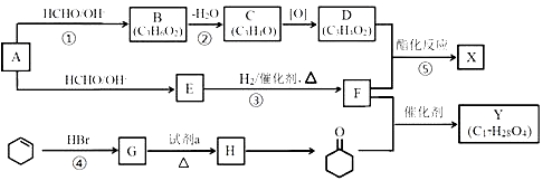
已知:Ⅰ.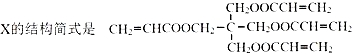
Ⅱ.![]()
Ⅲ.![]()
(1)B中含氧官能团的名称是___________。
(2)A的结构简式是______________。
(3)任选1种具有反式结构的C的同系物,用结构简式表示其反式结构_______。
(4)反应②、③、④、⑤中与反应①的类型相同的是_________。
(5)G→H的化学方程式是__________。
(6)E的结构构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:反应
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ΔH = —184 kJ/mol
H2O(g) = H2O(l) ΔH = —44 kJ/mol
写出H2燃烧热的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:![]() ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)在一定体积的密闭容器中,进行如下化学反应:
A(g) + 3B(g)![]() 2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
T/K | 300 | 400 | 500 | … |
K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)已知N2 (g)+ 3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
①在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为: ,用氮气表示的反应速率为: 。
②保持①中的温度和容积不变,设a、b、c分别代表初始加入的N2、H2、NH3的物质的量,若反应达平衡后,混合气体中NH3的体积分数与①中的相同,那么: 若a= 0.5,c= 3,则b= ,在此情况下反应起始时将向 反应方向进行。
③保持①中的温度和容积不变,若按下列四种配比作为起始物质,达平衡后容器内N2的转化率大于①中的是 。(填序号)
A.4molNH3 B.1.5molN2、7.5molH2和1molNH3
C.1molN2、5molH2和2molNH3 D.1molN2、6molH2和2molNH3
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
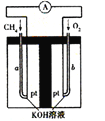
①放电时,负极的电极反应式为 。
②假设装置中盛装100.0 mL 3.0 mol·L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中的溶质是 电解质溶液中各离子浓度的大小关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据人民网报道,有一集团拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢气,其反应式可表示为:![]() 。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转化为化学能,以上叙述中正确的是
A.①② B.②③ C.③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质与结构—选作】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子
Al2Cl6中Al原子的轨道杂化类型是 。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构类型。
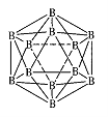
(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)= pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com