
����Ŀ��I����֪����Ӧ
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ��H = ��115.6 kJ/mol
2Cl2(g)+2H2O(g) ��H = ��115.6 kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ��H = ��184 kJ/mol
H2O(g) = H2O(l) ��H = ��44 kJ/mol
д��H2ȼ���ȵ��Ȼ�ѧ����ʽ ��
II��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��![]() ��������Ӧ�Ļ�ѧ����ʽΪ��
��������Ӧ�Ļ�ѧ����ʽΪ��
��2����һ��������ܱ������У��������»�ѧ��Ӧ��
A(g) + 3B(g)![]() 2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
T/K | 300 | 400 | 500 | �� |
K/(mol��L��1)2 | 4��106 | 8��107 | K1 | �� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<����
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ���
A��3v(B)������=2v(C)���棩 B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��3����֪N2 (g)+ 3H2(g)![]() 2NH3(g) ��H<0
2NH3(g) ��H<0
����һ���¶��£����ݻ����䣨ʼ��Ϊ10L�����ܱ������м���2 mol N2��8 mol H2 �����������10���Ӻ�Ӧ�ﵽƽ��״̬������������ѹǿ��Ϊ��ʼ��80������ʱ�������������Ϊ�� ���õ�����ʾ�ķ�Ӧ����Ϊ�� ��
�ڱ��֢��е��¶Ⱥ��ݻ����䣬��a��b��c�ֱ������ʼ�����N2��H2��NH3�����ʵ���������Ӧ��ƽ����������NH3�������������е���ͬ����ô�� ��a= 0.5��c= 3����b= ���ڴ�����·�Ӧ��ʼʱ���� ��Ӧ������С�
�۱��֢��е��¶Ⱥ��ݻ����䣬�����������������Ϊ��ʼ���ʣ���ƽ���������N2��ת���ʴ��ڢ��е��� ��������ţ�
A��4molNH3 B��1.5molN2��7.5molH2��1molNH3
C��1molN2��5molH2��2molNH3 D��1molN2��6molH2��2molNH3
��4������Ȼ��(�������ʲ����뷴Ӧ)Ϊԭ�ϵ�ȼ�ϵ��ʾ��ͼ��ͼ��ʾ��
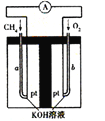
�ٷŵ�ʱ�������ĵ缫��ӦʽΪ ��
�ڼ���װ����ʢװ100.0 mL 3.0 mol��L-1 KOH��Һ���ŵ�ʱ���뷴Ӧ�������ڱ�״�������Ϊ8960 mL���ŵ���Ϻ������Һ�е������� �������Һ�и�����Ũ�ȵĴ�С��ϵΪ ��
���𰸡��� H2(g) + 1/2O2(g)= H2O(l) ��H= ��285.8 kJ/mol
�� ��1��C��S��+H2O(g) ![]() H2(g) + CO(g)
H2(g) + CO(g)
��2�� �� �� �� CD
��3�� 25% 0.01mol/(Lmin) 3.5 ��
��4����CH4-8e��+10OH��= CO32��+7H2O ��c(K��)>c(HCO3��)>c(CO32��)>c(OH��)>c(H��)
��������
�����������1����4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ��H = ��115.6 kJ/mol����H2(g) + Cl2(g) = 2HCl(g) ��H = ��184 kJ/mol���� H2O(g) = H2O(l) ��H = ��44 kJ/mol�����ݸ�˹���ɣ��١�2+��+�۵õ�-115.6��2-184-44=-285.8kJ/mol����H2ȼ���ȵ��Ȼ�ѧ����ʽΪH2(g) + 1/2O2(g)= H2O(l) ��H= ��285.8 kJ/mol��
2Cl2(g)+2H2O(g) ��H = ��115.6 kJ/mol����H2(g) + Cl2(g) = 2HCl(g) ��H = ��184 kJ/mol���� H2O(g) = H2O(l) ��H = ��44 kJ/mol�����ݸ�˹���ɣ��١�2+��+�۵õ�-115.6��2-184-44=-285.8kJ/mol����H2ȼ���ȵ��Ȼ�ѧ����ʽΪH2(g) + 1/2O2(g)= H2O(l) ��H= ��285.8 kJ/mol��
��1��ƽ�����ʽΪ��K=c(H2)c(CO)/c(H2O) ��������ΪCO��H2����Ӧ�ﺬ��H2O������ѧ�������ֱ�Ϊ1��1��1������Ԫ���غ㣬��һ��Ӧ��Ϊ����C����Ӧ��Ӧ�Ļ�ѧ����ʽΪC��S��+H2O(g) ![]() H2(g) + CO(g)��
H2(g) + CO(g)��
��2���ٸ��ݱ����ṩ����Ϣ���¶����ߣ�Kֵ����˵���÷�Ӧ������ӦΪ���ȷ�Ӧ������H>0��
�ڸ������淴Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿɵ�2v(B)������=3v(C)���棩��A�����A��B��ת��������뷴Ӧƽ������أ�ֻҪ�����ϵ���ȼ���A��B��A��B��ת���ʾ���ͬ��B����˷�ӦA(g) + 3B(g)![]() 2C(g) + D��s����һ������ϵ�������仯�ķ�Ӧ����������ѹǿ���ֲ������������ܶȱ��ֲ������ʹ�˷�Ӧ�ﵽƽ�⣬C��D��ȷ����ѡCD��
2C(g) + D��s����һ������ϵ�������仯�ķ�Ӧ����������ѹǿ���ֲ������������ܶȱ��ֲ������ʹ�˷�Ӧ�ﵽƽ�⣬C��D��ȷ����ѡCD��
��3������һ���¶��£����ݻ����䣨ʼ��Ϊ10L�����ܱ������м���2 mol N2��8 mol H2 �����������10���Ӻ�Ӧ�ﵽƽ��״̬������������ѹǿ��Ϊ��ʼ��80������������ʽ���
N2 (g)+ 3H2(g)![]() 2NH3(g) ��H<0
2NH3(g) ��H<0
��ʼ���ʵ���(mol) 2 8 0
�仯���ʵ���(mol) n 3n 2n
ƽ�����ʵ���(mol) 2-n 8-3n 2n 2-n+8-3n+2n=10��0.8�����n=1
��ʱ�������������Ϊ��2��8��100%=25%���õ�����ʾ�ķ�Ӧ����Ϊ��1mol��(10L��10min)= 0.01mol/(Lmin)��
�ڱ��֢��е��¶Ⱥ��ݻ����䣬��a��b��c�ֱ������ʼ�����N2��H2��NH3�����ʵ���������Ӧ��ƽ����������NH3�������������е���ͬ��˵����ʱ������ƽ����ԭƽ���Ч�����ݵ�Чƽ�⽨���Ĺ��ɣ���3mol����ȫ����Ӧ�ɵ���������������1.5mol������4.5mol������b=8-4.5=3.5������������Ӧ�ﵽƽ��ʱ����Ϊ5mol��֪���ڴ�����·�Ӧ��ʼʱ�����淴Ӧ������С�
��A��4molNH3�൱��2mol������6mol������ϣ�Ҳ�൱���ڵ���2mol������8mol�Ļ����ϼ������������ʵ�����ƽ�������ƶ���������ƽ��ת���ʼ�С��B��1.5molN2��7.5molH2��1molNH3�൱��2mol������9mol������Ҳ�൱����2mol������8mol�����Ļ���������1mol������������ת��������C��1molN2��5molH2��2molNH3�൱��2mol������8mol��������ԭƽ���ǵ�Чƽ�⣬������ת���ʲ��䣻D��1molN2��6molH2��2molNH3�൱��2mol������9mol������Ҳ�൱����2mol������8mol�����Ļ���������1mol������������ת��������ѡBD��
��4���ٸ�������������Ӧ�������ڸ����ŵ�����̼������ӣ������缫��ӦʽΪCH4-8e��+10OH��= CO32��+7H2O��
�ڲ��뷴Ӧ�������ڱ�״�������Ϊ8960mL�����ʵ���Ϊ8.96L/22.4L/mol =0.4mol�����ݵ���ת���غ��֪�����ɶ�����̼Ϊ(0.4mol��4 )/8 =0.2mol��n��NaOH��=0.1L��3.0molL-1=0.3mol��n��NaOH����n��CO2��=0.3mol��0.2mol=3��2������1��1��2��1֮�䣬����̼��ء�̼����أ���̼��ء�̼����ص����ʵ����ֱ�Ϊxmol��ymol����x+y=0.2��2x+y=0.3�����x=0.1��y=0.1����Һ��̼���ˮ�⣬̼�������ˮ����ڵ��룬��Һ�ʼ��ԣ�c��OH-����c��H+����̼�����ˮ��̶ȴ���̼�������c��HCO3-����c��CO32-����������Ũ�����ˮ��̶Ȳ���̼���Ũ��Զ�������������ӣ�c��K+����c��HCO3-����c��CO32-����c��OH-����c��H+����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ƚ������ⷽ������������������������������Ӧϵͳͬʱͨ����顢������ˮ��������������Ҫ��ѧ��Ӧ�У�
��Ӧ | ��ѧ����ʽ | �ʱ���H | ����Ӧ���Ea |
���� | CH4��g����2O2��g����CO2��g����2H2O��g�� | ��802��6 | 125��6 |
CH4��g����O2��g����CO2��g����2H2��g�� | ��322��0 | 172��5 | |
���� | CH4��g����H2O��g����CO��g����3H2��g�� | 206��2 | 240��1 |
CH4��g����2H2O��g����CO2��g����4H2��g�� | 165��0 | 243��9 |
�ش��������⣺
��1����ӦCO��g����H2O��g����CO2��g����H2��g������H= kJ/mol��
��2���ڳ�ʼ��,�������������ķ�Ӧ���� ���������ķ�Ӧ���ʣ�����ڡ�С�ڻ���ڣ���
��3���������෴Ӧ����ij��֣�B����ƽ��ѹǿ��PB���������ʵ���Ũ�ȣ�cB��Ҳ�ɱ�ʾƽ�ⳣ��������KP������ӦCH4��g����H2O��g��![]() CO��g����3H2��g��KP�ı���ʽΪ �������¶ȵ����ߣ���ƽ�ⳣ�� ������������������С����������������
CO��g����3H2��g��KP�ı���ʽΪ �������¶ȵ����ߣ���ƽ�ⳣ�� ������������������С����������������
��4���������Ƕȷ������������������������Ƚ�֮������ ��
��5����ijһ�������ϱȵ�����£��¶ȡ�ѹǿ��H2��CO���ʵ���������Ӱ������ͼ��
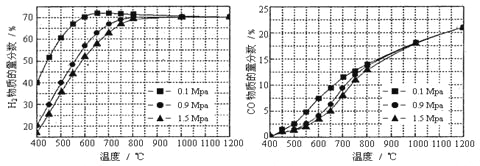
����Ҫ�ﵽH2���ʵ�������>65%/span>��CO�����ʵ�������<10%����������������ʵ��� ��
A��600����0.9Mpa B��700����0.9Mpa C��800����1.5Mpa D��1000����1.5MPa
������600����0��1Mpa�����£�ϵͳ��H2���ʵ��������淴Ӧʱ�䣨�ӳ��½��Ͽ�ʼ��ʱ���ı仯����ʾ��ͼ��
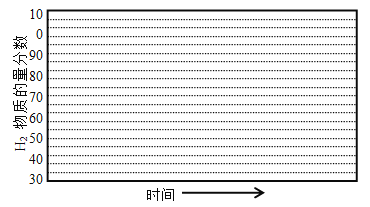
��6������������������������յ���H2���ʵ����������ͣ�ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ,��һ��2 L���ܱ�������,X��Y��Z�����������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ������,����д���пհף�
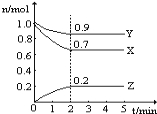
��1���÷�Ӧ�Ļ�ѧ����ʽΪ ______ __ ��
��2���÷�Ӧ���� ��ʼ�ġ���������Ӧ���淴Ӧ�����淴Ӧͬʱ����
��3���÷�Ӧ�� ______ ���ӵ���ƽ��״̬��
��4����Ӧ��ʼ��3 min,����X��ƽ����Ӧ����Ϊ _______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ(������������������ȥ�����з�Ӧ�ڵ������ǡ�700 �棬������)��G�dz����ĺ�ɫ�������ʣ�B��H�ǿ�������Ҫ�ɷ֣�A��C��E���dz������壬D���������ɫҺ�塣
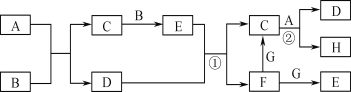
��ش��������⣺
��1��E�Ļ�ѧʽΪ________________��
��2��A�ĵ���ʽΪ________________��
��3��д����Ӧ�ٵ����ӷ���ʽ��________________________________��
��4��д����Ӧ�ڵĻ�ѧ����ʽ�����������ת�Ƶķ�������Ŀ��
______________ __________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǽ�SO2ת��Ϊ��Ҫ�Ļ���ԭ��H2SO4��ԭ��ʾ��ͼ������˵������ȷ����

A����װ�ý���ѧ��ת��Ϊ��������������Ϊb![]() a
a
B������b����O2������ԭ��Ӧ���丽��������ǿ
C������a����ķ�Ӧ�ǣ�SO2+2H2O-2e-=SO42-+4H+
D�����õ�������Ũ����Ϊ49%���������ϲμӷ�Ӧ��SO2������H2O��������Ϊ8��15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������1L0.1molL��1CH3COONa��Һ��������ͨ��HCl������CH3COO����CH3COOH �ı仯������ͼ��ʾ������HCl��ȫ�����Ҳ�����CH3COOH�ӷ�����Һ����仯��������˵������ȷ����
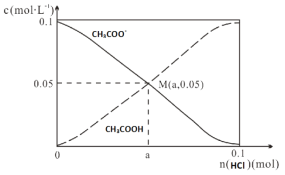
A��M����Һ��ˮ�ĵ���̶ȱ�ԭ��ҺС
B����M��ʱ��n��H+��-n��OH��������0.05-a ��mol
C������HCl�ļ��룬![]() ���ϼ�С
���ϼ�С
D����n��HCl����0.1molʱ��c��Cl������c��CH3COOH����c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��D��E��FΪ������Ԫ�أ��ǽ���Ԫ��A����������������������ͬ��B����������������������������2����B ��D�г��ȼ������������ۻ�����BD2��E����D2��������ͬ�ĵ�������A��F��ȼ�գ���������ˮ�õ�һ��ǿ�ᡣ�ش��������⣺
��1�� A��B��D��E��F��ԭ�Ӱ뾶�ɴ�С���е�˳��Ϊ__________(��Ԫ�ط��ű�ʾ)
��2�� ��ҵ�Ʊ�F���ʵ����ӷ�Ӧ����ʽΪ_________________��
��3�� ����ЩԪ����ɵ����ʣ�����ɺͽṹ��Ϣ���±���
���� | ��ɺͽṹ��Ϣ |
a | ����A�Ķ�Ԫ���ӻ����� |
b | ��D��E���ɣ���ԭ����֮��Ϊ1:1 |
c | ��ѧ���EDF |
d | ֻ����һ�������������ҿɵ���ĵ��ʾ��� |
a�Ļ�ѧʽ ��b�Ļ�ѧ������ ��
c��һ������ ��d�ľ������� ��
��4�� ��A��B��DԪ����ɵ����ֶ�Ԫ�������γ�һ������Դ���ʡ�����һ�ֻ��������ͨ�� �����ɾ��п�ǻ�Ĺ��壻��һ�ֻ�������ӽ���ÿ�ǻ���γɿ�ȼ���塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ�����ʡ�
A��B��C��D��EΪԭ��������������������Ԫ����A��һ��ͬλ�ؿ����ڿ����вⶨ�������������� B��Aͬ���ڣ���s�ܼ���������p�ܼ��������ࣻCԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ������Ϊ29���ش�����������
��1������Ԫ���е�һ������������ ����Ԫ�ط��ţ�������Dԭ�Ӽ۵����Ų�ͼΪ ��
��2��Ԫ��B�ļ���̬�⻯��ķе� ������ڡ��������ڡ���Ԫ��A�ļ���̬�⻯��ķе㣬����Ҫԭ���� �� A�ļ���̬�⻯������ԭ�ӵ��ӻ��������Ϊ ��
��3��BC3-�����幹��Ϊ ��������Ϊ�ȵ�����ķ����� ��д��ѧʽ����
��4��EC�ڼ�������������ת��ΪE2C����ԭ�ӽṹ�ĽǶȽ���ԭ�� ��Eԭ�ӵ���Χ�����Ų�ʽΪ ��E����Ķѻ���ʽΪ ������ţ�
���������ѻ� �����������ѻ�
���������ܶѻ� �������������ܶѻ�
��5������D���γ�һ����ĥ����F����ṹ����ʯ���ƣ�����ͼ��������������廯���D�����廯���ڸ������������ķ�Χ�кϳɡ�д���ϳ�F�Ļ�ѧ����ʽ�� ��F�ľ����߳�Ϊa pm����þ����ܶȵı���ʽΪ g��cm-3�� (�ú�a��NA��ʽ�ӱ�ʾ�����ػ���
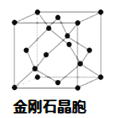
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������뼼��--ѡ��������������SnSO4����һ����Ҫ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С�����SnSO4�Ʊ�·�����£�
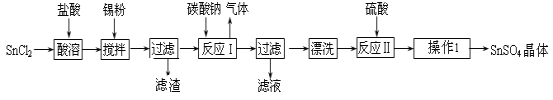
�������ϣ������������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ�������
��SnCl2��ˮ�����ɼ�ʽ�Ȼ������� Sn���ԭ������Ϊ119��
�ش��������⣺
��1����ԭ�ӵĺ˵����Ϊ50����̼Ԫ������ͬһ���壬��Ԫ�������ڱ��е�λ���� ��
��2���������� ��
��3��SnCl2��ĩ���Ũ��������ܽ⣬����ƽ���ƶ�ԭ������ԭ�� ��
��4������Sn�۵��������������ٵ�����ҺpH �� ��
��5�����������£�SnSO4����������˫��ˮȥ������������Ӧ�����ӷ���ʽ�� ��
��6����С��ͨ�����з����ⶨ�������۵Ĵ��������ʲ����뷴Ӧ����
�ٽ��������������У������ķ�ӦΪ��Sn + 2HCl=SnCl2 + H2����
�ڼ��������FeCl3��
������֪Ũ�ȵ�K2Cr2O7�ζ����ɵ�Fe2+�������ķ�ӦΪ��6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O��ȡ1.226 g ���ۣ�������������Ӧ����ȥ0.100 mol/L K2Cr2O7��Һ32.0 ml���������������������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com