
【题目】原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24。
(1)Z原子基态核外电子排布式为_____________。
(2)元素X与Y的第一电离能较大的__________________(填元素符号);H2Y2中Y原子轨道的杂化类型为__________。
(3)+3价Z的配合物K[Z(C2O4)2(H2O)2]中的配体是____________;与C2O42-互为等电子体的一种分子的化学式为_________。
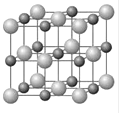
(4)Cu和Y形成的化合物的晶胞如图所示,晶胞中与铜离子距离相等且最近的铜离子有________个。某种有缺陷的铜和Y形成的化合物的晶体由Cu2+、Cu3+、Y2-及空隙组成,可表示为Cu0.98Y,则n(Cu2+)/n(Cu3+)=_________。
【答案】 1s22s22p63s23p63d54s1或[Ar]3d54s1 N sp3 H2O、C2O42- N2O4 12 47:2
【解析】试题分析:原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1,核外电子排布式为1s22s22p3,故X为N元素;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,核外电子排布式为1s22s22p4,故Y为O元素;Z的原子序数为24,Z为Cr;
(1)Cr原子核外电子数为24,能量最低原理原理、洪特规则特例,核外电子排布式为:1s22s22p63s23p63d54s1;
(2)N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,即N元素第一电离能高于O元素的;H2O2中O原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4,O原子采取sp3杂化;
(3)+3价Cr的配合物K[Cr(C2O4)2(H2O)2]中的配体是H2O、C2O42-,与C2O42-互为等电子体的一种分子的化学式为:N2O4;
(4)晶胞中灰色球数目为4、黑色球数目为4,以顶点灰色球研究,与之距离最近的原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,即晶胞中与铜离子距离相等且最近的铜离子有![]() ="12" 个,根据电荷守恒,则2n(Cu2+)+3n(Cu3+)=2,由原子守恒可知n(Cu2+)+n(Cu3+)=0.98,解得n(Cu2+)=0.94,n(Cu3+)=0.04,故n(Cu2+):n(Cu3+)=
="12" 个,根据电荷守恒,则2n(Cu2+)+3n(Cu3+)=2,由原子守恒可知n(Cu2+)+n(Cu3+)=0.98,解得n(Cu2+)=0.94,n(Cu3+)=0.04,故n(Cu2+):n(Cu3+)=![]() 。
。


科目:高中化学 来源: 题型:
【题目】I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2 ⑦氦气
(1)这些物质中,只含共价键的是 。只含离子键的是 。既含共价键又含离子键的是 。
(2)属于离子化合物的是 。
II.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。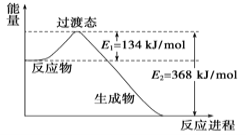
(2)已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要_____________(填“放出”或“吸收”)_____________kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为_____________,G的原子结构示意图是__________________________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为_________,所含化学键类型为___________,向甲中滴加足量水时发生反应的化学方程式是____________________________。
(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是__________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的________极,正极的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
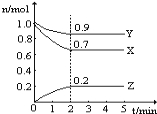
(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应②逆反应③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】推断题
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:

(1)写出下列元素名称:A B C D E F .
(2)写出元素C的离子结构示意图____________。
(3)D、E、F的简单离子半径由大到小的顺序是 。
(4)B与C形成的化合物,既含有离子键又含有非极性键,该化合物的电子式为_______________。
(5)A、C、E三种元素形成的具有漂白性的化合物,该化合物的结构式为 。
(6)D与E形成的化合物的类别是________________(填共价化合物或离子化合物)。
(7)能证明C的非金属性比F强的实验事实是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去,其中反应②的条件是“700 ℃,催化剂”)。G是常见的红色金属单质,B、H是空气的主要成分,A、C、E均是常见气体,D是最常见的无色液体。
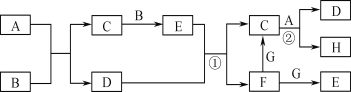
请回答下列问题:
(1)E的化学式为________________。
(2)A的电子式为________________。
(3)写出反应①的离子方程式:________________________________。
(4)写出反应②的化学方程式,并标出电子转移的方向与数目:
______________ __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是

A.该装置将化学能转化为电能,电流方向为b![]() a
a
B.催化剂b表面O2发生还原反应,其附近酸性增强
C.催化剂a表面的反应是:SO2+2H2O-2e-=SO42-+4H+
D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1) A、B、D、E、F的原子半径由大到小排列的顺序为__________(用元素符号表示)
(2) 工业制备F单质的离子反应方程式为_________________。
(3) 由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 由D和E构成,且原子数之比为1:1 |
c | 化学组成EDF |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式 ;b的化学键类型 ;
c的一种作用 ;d的晶体类型 。
(4) 由A和B、D元素组成的两种二元化合物形成一类新能源物质。其中一种化合物分子通过 键构成具有空腔的固体;另一种化合物分子进入该空腔,形成可燃固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出:
(1)一核10电子的阳离子的符号_________;
(2)两核10电子的阴离子的电子式___________;
(3)三核10电子的共价化合物的电子式_______;
(4)四核10电子的阳离子的电子式:__________;
(5)四核10电子的共价化合物的结构式_________;
(6)五核10电子的阳离子的化学式___________;
(7)五核10电子的共价化合物的结构式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com