
【题目】推断题
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:

(1)写出下列元素名称:A B C D E F .
(2)写出元素C的离子结构示意图____________。
(3)D、E、F的简单离子半径由大到小的顺序是 。
(4)B与C形成的化合物,既含有离子键又含有非极性键,该化合物的电子式为_______________。
(5)A、C、E三种元素形成的具有漂白性的化合物,该化合物的结构式为 。
(6)D与E形成的化合物的类别是________________(填共价化合物或离子化合物)。
(7)能证明C的非金属性比F强的实验事实是 。
【答案】(1)氢 钠 氧 铝 氯 硫(2)![]() (3)S2->Cl->Al3+(4)
(3)S2->Cl->Al3+(4)![]()
(5)H-O-Cl(6)共价化合物(7)水比硫化氢稳定
【解析】试题分析:(1)A的单质是密度最小的物质,故A是氢元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂
的主要成分是次氯酸钠,所以E是氯元素;F元素最高正价与最低负价的代数和为4,且F是短周期元 素,所以F是硫元素;
(2)据(1)分析,氧离子的结构示意图是![]() 。
。
(3)铝离子的电子层数小于硫离子、氯离子的电子层数,电子层数越多,离子半径越大,所以铝离子半径小于氯离子和硫离子半径;电子层数相同的离子,离子半径随着原子序数的增大而减小,所以硫离 子半径大于氯离子半径,则为S2->Cl->Al3+。
(4)B与C形成的化合物,既含有离子键又含有非极性键,是过氧化钠,电子式为:![]() 。
。
(5)A、C、E三种元素形成的具有漂白性的化合物是次氯酸,该化合物的结构式为H-O-Cl。
(6)D与E形成的化合物是氯化铝,类别是共价化合物。
(7)非金属性强弱可用氢化物稳定性判断。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】【化学–选修2:化学与技术】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
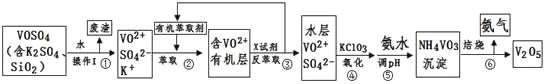
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4 (水层)
2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 。
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式: 。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。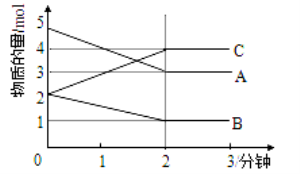
(3)该反应的的化学方程式为 。
(4)反应开始至2分钟时,B的平均反应速率为 。
(5)能说明该反应已达到平衡状态的是 。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(6)由图求得平衡时A的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH=2K2CO3+6H2O
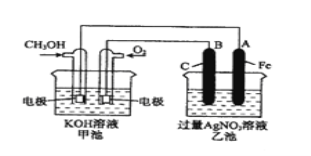
(1)请回答图中甲、乙两池的名称。甲电池是 装置,乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4)Z2Y2中的化学键类型是_____________________;Z2Y2与水反应放出气体的离子方程式为
________ _____。
(5) 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2![]() Fe + 2ZG 放电时,电池的负极材料为______,发生 反应
Fe + 2ZG 放电时,电池的负极材料为______,发生 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24。
(1)Z原子基态核外电子排布式为_____________。
(2)元素X与Y的第一电离能较大的__________________(填元素符号);H2Y2中Y原子轨道的杂化类型为__________。
(3)+3价Z的配合物K[Z(C2O4)2(H2O)2]中的配体是____________;与C2O42-互为等电子体的一种分子的化学式为_________。
(4)Cu和Y形成的化合物的晶胞如图所示,晶胞中与铜离子距离相等且最近的铜离子有________个。某种有缺陷的铜和Y形成的化合物的晶体由Cu2+、Cu3+、Y2-及空隙组成,可表示为Cu0.98Y,则n(Cu2+)/n(Cu3+)=_________。
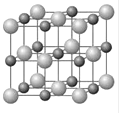
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1) CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
CH2=CH2(g)+4H2O(g) △H=akJ·mol-1已知:H2(g)的燃烧热为285.8kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0kJ·mol-1,H2O(g)=H2O(l)
△H=-44.0kJ·mol-1,则a=______kJ·mol-1。
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如图,下列有关说法不正确的是_______(填序号)

①温度越高,催化剂的催化效率越高
②温度低于250℃时,随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)2012年科学家根据光合作用原理研制出“人造树叶”。右图是“人造树叶”的电化学模拟实验装置图,该装置能将H2O和CO2转化为O2和有机物C3H8O。

阴极的电极反应式为::_________________________
II.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(4)上述反应使用等质量的某种催化剂时,温度和催化剂的比表面积对化学反应速率的影响对比实验如下表,c(NO)浓度随时间(t)变化曲线如下图:


①表中a=___________。
②实验说明,该反应是__________反应(填“放热”或“吸热”)。
③若在500℃时,投料=1,NO的转化率为80%,则此温度时的平衡常数K=_____。
(5)使用电化学法也可处理NO的污染,装置如右图。已知电解池阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:__________。吸收池中除去NO的离子方程式为:__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图三条曲线表示C、Si和P元素的四级电离能变化趋势。下列说法正确的是( )
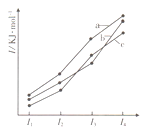
A. 电负性:c>b>a B. 最简单氢化物的稳定性:c>a>b
C. I5:a>c>b D. 最简单氢化物的沸点:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 。D的最高价氧化物的水化物是 。
(2)写出A、B的化合物与E反应的化学方程式: 。
(3)A、B两元素形成化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com