
����Ŀ������ѧ�Cѡ��2����ѧ�뼼������ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£�
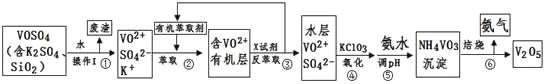
��ش��������⣺
��1�����������÷����ijɷ��� ��д��ѧʽ��������I������ ��
��2�������������ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+��HA��ʾ�л���ȡ������
R2(SO4)n(ˮ��)��2nHA���л��㣩![]() 2RAn���л��㣩��nH2SO4 (ˮ��)
2RAn���л��㣩��nH2SO4 (ˮ��)
������ȡʱ��������������ԭ���� ��
����X�Լ�Ϊ ��
��3���������ӷ���ʽΪ ��
��4��25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ ��
����������Ϊ93.1%ʱ������Fe(OH)3����������Һ��c(Fe3+)�� ��
����֪��25��ʱ��Ksp[Fe(OH)3]��2.6��10��39��
��5���ù��������У�����ѭ�����õ������� �� ��
���𰸡���1��SiO2��1�֣� ���ˣ�2�֣� ��2��������к����ᣬ��ʹƽ�������ƶ�����߷�����ȡ�ʣۻ����Ʊ����������RAn���л��㣩��Ũ�ȡ��ٷֺ����ȣݣ�2�֣� H2SO4��2�֣�
��3��6VO2+��ClO3����9H2O==6VO3����Cl����18H+��2�֣�
��4��1.7��1.8����1.7��1.8����һ������2�֣���2.6��10��3mol��L��1��2�֣�
��5����������ˮ����1�֣����л���ȡ����1�֣�
�������������������1�������ܽ��������費����ˮ����˹��˵õ���������Ҫ�ɷ�Ϊ�������裻
��2��������ȡʱ����������������ƽ��R2(SO4)n(ˮ��)��2nHA���л��㣩![]() 2RAn���л��㣩��nH2SO4 (ˮ��)��֪������ļ���ƽ���е������ӷ�Ӧ�ٽ�ƽ��������У�
2RAn���л��㣩��nH2SO4 (ˮ��)��֪������ļ���ƽ���е������ӷ�Ӧ�ٽ�ƽ��������У�
���з���ȡʱ�����X�Լ�������ƽ��������У����Լ�����������ƽ��������У�
��3�����������������������VO2+����Ӧ����Ԫ�ػ��ϼ۴ӣ�5�۽��͵���1�ۣ��õ�6�����ӡ�VԪ�ػ��ϼۣ�4�����ߵ���5�ۣ�ʧȥ1�����ӣ����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��Ӧ�����ӷ���ʽΪ6VO2+��ClO3����9H2O==6VO3����Cl����18H+��
��4�����ݱ��������жϣ����м��백ˮ��������ҺpH���ֵΪ1.7��1.8����ʱ�������ʴﵽ�����Ҫ��ˮ����С������������Ϊ93.1%ʱ������Fe��OH��3��������ʱpH=2��c��H+��=0.01mol/L��c��OH-��=10-12mol/L������Һ��c��Fe3+��Ũ�������ܶȻ����㣬��Ksp[Fe��OH��3]=c��Fe3+����c3��OH-��=2.6��10-39�����c��Fe3+��=2.6��10-3molL-1��������Fe��OH��3����������Һ��c��Fe3+����2.6��10-3molL-1��
��5����������ͼ�����ʲμӷ�Ӧ����Ӧ�����������ɵ����ʣ��ظ����õ����ʿ���ѭ�����ã��������л���ȡ������������ѭ�����á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ�ʳƷ���ϵ��л�������A������Է�������Ϊ120��Aȼ��ֻ���ɶ�����̼��ˮ��A�ȿ������Ҵ�����������Ӧ���ֿ��������ᷢ��������Ӧ���Ҳ��A���Ҵ���ȫ���������л�����B����Է�������Ϊ176����ش��������⣺
��1��A�ķ���ʽΪ ��
��2��B�Ľṹ��ʽ ��
��3��A�����ᷢ��������Ӧ�Ļ�ѧ����ʽ ��
��4���ɱ�ϩ��������������Ժϳ��л�������A���������£�
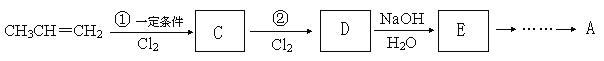
��C�ķ���ʽΪC3H5Cl��D�ķ���ʽΪC3H5Cl3����ٵķ�Ӧ����Ϊ ��
D��E��Ӧ�Ļ�ѧ����ʽΪ ��
�벹�����E��A�ķ�Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��BPA�Ľṹ��ʽ������ͼ��ʾ�������������������Ͼ�̼������

��1�������ʵķ���ʽΪ___________�����������ŵ�������_________������____�ࡣ
��2�����������_____��̼ԭ�ӹ��档
��3�����ȼ��0.1mol���л�����ĵ�O2�ڱ�״���µ����Ϊ_________��
��4�����й���BPA�������У�����ȷ����_______��
A�����Է�����ԭ��Ӧ
B����FeCl3��Һ��ɫ
C��1mol���л���������2molH2��Ӧ
D������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ������ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | A�е����� | B�е����� | C���ռ������� | D�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ����ǵĺ˵������C��A��B��D��E��˳������C��D���ֱܷ���A��ԭ�Ӹ�����Ϊ1��1 ��2��1�γɻ����CB����EA2��Ӧ����C2A����̬����EB4��E��M���������K���������2����
��1��д��������Ԫ�ص����ƣ�A ��B ��C ��D ��E ��
��2������E��ԭ�ӽṹʾ��ͼ ��д������ʽD2A2 ��EB4 ��
��3���Ƚ�EA2��EB4���۵�ߵ�(�ѧʽ) > ��
��4��д��D������CuSO4��Һ��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��������ѧ��ѧ����Ϥ�����ʣ�������������������
��O2 ��Na2O2 ��NH4Cl ��HCl ��NaOH ��CaCl2 ������
��1����Щ�����У�ֻ�����ۼ����� ��ֻ�����Ӽ����� ���Ⱥ����ۼ��ֺ����Ӽ����� ��
��2���������ӻ�������� ��
II.��1��20����30�����Eyring��Pzer����ײ���۵Ļ����������ѧ��Ӧ�Ĺ���̬���ۣ���ѧ��Ӧ������ͨ������ײ������ɵģ������ڷ�Ӧ�ﵽ������Ĺ����о���һ���������Ĺ���̬����ͼ��NO2��CO��Ӧ����CO2��NO�����е������仯ʾ��ͼ��˵�������Ӧ�� ������ȡ����ȡ�����Ӧ��NO2��CO�������� ������ڡ�����С�ڡ����ڡ���CO2��NO����������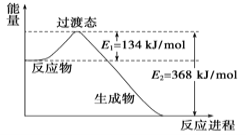
��2����֪��1molH��H����1mol I��I��1mol H��I���ֱ���Ҫ���յ�����Ϊ436kJ��151kJ��299kJ�����������͵ⷴӦ����1mol HI��Ҫ_____________����ų��������ա���_____________kJ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����ǻ�ѧ�������һ���ش��ס�ij��ȤС��Ϊ�о�ԭ���ԭ���������ͼװ�ã�

��1��a��b������ʱ���ձ��������� ��
��2��a��b�õ������ӣ�Cu��Ϊԭ���_________�����������������
�缫��ӦʽΪ�� ����Һ��H+����____________
���Cu����Zn������������ܷ�ӦʽΪ�� ��
���������Һ��ΪAgNO3��Һ����ת��0.2mol����ʱ����������CuƬ�����仯Ϊ___ ___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�Ļ���ԭ�ϣ����Ʊ�ԭ���ǣ�
![]()
![]()
���¶��Ըߵ�����»����ɸ���������������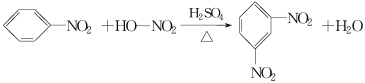
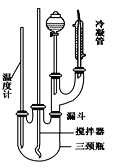
�뽫�����Ʊ���������ʵ��������д������
��1����������ƣ�ȡ100 mL�ձ�����Ũ����20 mL��Ũ����18 mL���ƻ��ᣬ���������Ϊ__________________________________
��2����װ��Ӧװ�ã���ͼ��ʾ��װʵ��װ�ã������ʵ���������ܵ������� _
��3����Ӧ���裺�ٰ�18 mL�ı����뵽����ƿ�У���������뵽��Һ©���У���εμӻ��ᣬ�ߵμӱ߽��裬��������Ŀ����____________________________ _
�ڻ���μ���Ϻ��ڼ��Ƚ���������·�Ӧ��Сʱ�����Ƽ����¶ȵķ�����___ ____ ��
�۷�����ᴿ����ȥ������û�з�Ӧ���ᣬ���ڲ����м������Һ��Ȼ���÷�Һ©����Һ��______������Ϊ�ֲ�Ʒ����ȥ��������û�з�Ӧ�ı������ɵĸ�����ļ�㷽����(�������)__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ƶ���
��A��B��C��D��E��F���ֶ�����Ԫ�أ���Ԫ��������Ϣ���±���

��1��д������Ԫ�����ƣ�A B C D E F .
��2��д��Ԫ��C�����ӽṹʾ��ͼ____________��
��3��D��E��F�ļ����Ӱ뾶�ɴ�С��˳���� ��
��4��B��C�γɵĻ�����Ⱥ������Ӽ��ֺ��зǼ��Լ����û�����ĵ���ʽΪ_______________��
��5��A��C��E����Ԫ���γɵľ���Ư���ԵĻ�����û�����ĽṹʽΪ ��
��6��D��E�γɵĻ�����������________________(��ۻ���������ӻ�����)��
��7����֤��C�ķǽ����Ա�Fǿ��ʵ����ʵ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com