
【题目】【化学——选修2化学与技术】
铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。
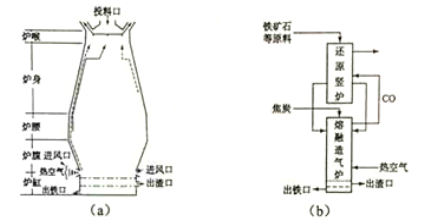
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2 和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的
部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2 污染空气,脱SO2 的方法是 。
【答案】(1)石灰石CaCO3![]() CaO+CO2↑、CaO+SiO2
CaO+CO2↑、CaO+SiO2![]() CaSiO3;CO。
CaSiO3;CO。
(2)-355;②③,①
(3)炉身,Fe2O3 + 3CO![]() 2Fe+3CO2;炉腹
2Fe+3CO2;炉腹
(4)用碱液吸收(氢氧化钠溶液或氨水等)
【解析】
试题分析:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可以加入石灰石,石灰石分解为氧化钙,氧化钙和二氧化硅反应生成硅酸钙;加入焦炭,先生成CO,最后生成CO2;
(2)利用盖斯定律将①+②x3得到Fe2O3 (s)+3 C(s)+ ![]() O2(g)=2Fe(s)+3CO2 (g)的ΔH,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
O2(g)=2Fe(s)+3CO2 (g)的ΔH,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
(3)高炉炼铁时,炉身部分发生Fe2O3+3 CO====2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2![]() 2CO以及CaCO3
2CO以及CaCO3![]() CaO+CO2↑,CaO+SiO2
CaO+CO2↑,CaO+SiO2![]() CaSiO3反应;
CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。反应1、3的活化能如图2所示。
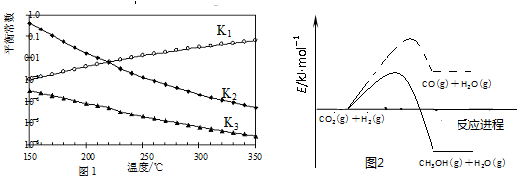
(1)则ΔH2________ΔH3(填“大于”、“小于”或“等于”),理由是________。
(2)反应1中ΔS1______0(填>、=或<=),指出有利于自发进行的温度条件____(填“较高温度”或:“较低温度”)
(3)将体积比为1:1的H2和CO2充入容积可变密闭容器内,若只进行反应1,下列措施中能使平衡时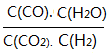 增大的是____________(填序号)
增大的是____________(填序号)
A.升高温度B.增大压强C.充入一定量的CO2 D.再加入一定量铁粉
(4)为了提高CO2和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是____________
(5)在温度为300℃时,使-定量合适体积比为的H2和CO2在体积恒定的密闭容器内进行反应。该温度下反应2进行程度很小可看成不进行,请在图3中画出CO、CH3OH浓度随时间变化至平衡的定性曲线图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液)。
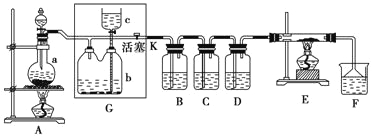
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为______。
(2)如何检查装置G的气密性:______(写出操作方法和现象)。
(3)G中b瓶内宜加入的液体是______;实验开始后B中的现象是______,C中的现象是______,F的现象是______。
(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个电化学装置的示意图。
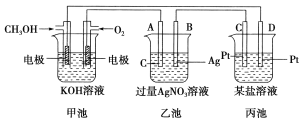
请回答下列问题:
(1)图中甲池是________(填“原电池”、“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”、“负极”、“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_________________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极质量增加5.4 g时,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________(填字母)。
A. MgSO4 B.CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | A中的物质 | B中的物质 | C中收集的气体 | D中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示,其中W的单质是空气的主要成分,化学性质稳定,不易参加化学反应,则下列有关说法中错误的是
![]()
A. W和Y可以形成稳定的化合物,耐热性好,是新型陶瓷材料
B. Z元素的最高价氧化物水化物的酸性强于Y
C. 四种元素常见的氢化物,一定是Y元素形成的氢化物最不稳定
D. 向氢化物WH3与HZ反应后的集气瓶中加入足量的水,所得溶液一定呈酸性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2 ⑦氦气
(1)这些物质中,只含共价键的是 。只含离子键的是 。既含共价键又含离子键的是 。
(2)属于离子化合物的是 。
II.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。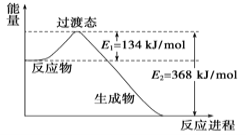
(2)已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要_____________(填“放出”或“吸收”)_____________kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应 | 化学方程式 | 焓变△H | 正反应活化能Ea |
甲烷 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
蒸汽 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
CO(g)+3H2(g)KP的表达式为 ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
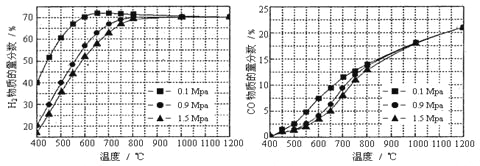
①若要达到H2物质的量分数>65%/span>、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9Mpa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
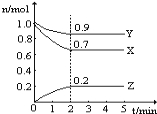
(1)该反应的化学方程式为 ______ __ 。
(2)该反应是由 开始的。(①正反应②逆反应③正逆反应同时。)
(3)该反应第 ______ 分钟到达平衡状态。
(4)反应开始至3 min,气体X的平均反应速率为 _______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com