
����Ŀ������ͼ��ʾ��һ����ȡ������������Ϊԭ�Ͻ����ض���Ӧ��װ�ã��������������������bƿ�У����и��Լ�ƿ����װ�Լ�Ϊ��B(������)��C(�⻯�ص�����Һ)��D(ˮ)��F(��ɫʯ����Һ)��
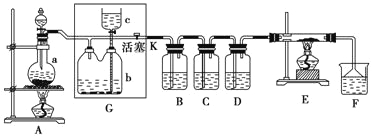
��1����A����ƿ�еĹ���ΪMnO2��Һ��ΪŨ���ᣬ���䷢����Ӧ�Ļ�ѧ����ʽΪ______��
��2����μ��װ��G�������ԣ�______��д����������������
��3��G��bƿ���˼����Һ����______��ʵ�鿪ʼ��B�е�������______��C�е�������______��F��������______��
��4��Eװ����Ӳ�ʲ�������ʢ��̿�ۣ���E�з���������ԭ��Ӧ�������Ϊ������̼���Ȼ��⣬д��E�з�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��������1��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2���ر�A�з�Һ©������G�л���K������ֹˮ�м�סA��G�����Ƥ�ܲ��ر�G�л���K������c�������ڼ�ˮ��c���¶˽���ҳ����c��Һ�����bƿ��Һ�棬��һ��ʱ���c��Һ�治�½�����Һ���ֲ��䣩����˵�������Ժ� ��3������ʳ��ˮ
�����ռ�����ɫ��Ϊ����ɫ����dz��ɫ��������
�ϲ��ռ�����ɫ��Ϊ����ɫ����Һ����ɫ
��ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ
��4��C+2Cl2+2H2O��g��![]() CO2+4HCl
CO2+4HCl
��������
�����������1��Aװ�õ���������ȡ�������仯ѧ��Ӧ����ʽΪMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
��2���ؼ�װ��G���ص���ж��������������������ǹر�A�з�Һ©������G�л���K������ֹˮ�м�סA��G�����Ƥ�ܲ��ر�G�л���K������c�������ڼ�ˮ��c���¶˽���ҳ����c��Һ�����bƿ��Һ�棬��һ��ʱ���c��Һ�治�½�����Һ���ֲ��䣩����˵�������Ժ���
��3��G���������ռ�������Aװ���в�������������HCl�����ܶ�ʵ�����Ӱ�죬�����ȥ�����b�е��Լ��ñ���ʳ��ˮ�������ǻ���ɫ���壬����ǿ�����ԣ���������������B����ʵ�������������ռ�����ɫ��Ϊ����ɫ����dz��ɫ���������������ܰѵ⻯������Ϊ�⣬������������ɫ����C����ʵ���������ϲ��ռ�����ɫ��Ϊ����ɫ����Һ����ɫ��������������������Һ��Ӧ����F����ʵ����������ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ��
��4��������CO2��HCl����˷�Ӧ��C��Cl2��CO2��HCl��C��0����4����4��Cl2��0����1����2����С������Ϊ4����C��2Cl2��CO2��4HCl����Ӧ����Ӧ��4��H��2��O����2��H2O����˷�Ӧ����ʽΪC+2Cl2+2H2O��g��![]() CO2+4HCl��
CO2+4HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿������[Al(NO3)3]��һ�ֳ���ýȾ������ҵ��������(��Ҫ��Al��Al2O3��Fe2O3��)��ȡ����������[Al(NO3)3��9H2O]���������£�

��1��д����Ӧ�������ӷ���ʽ�� (��дһ��)��
��2������ʵ��������ɷ�Ӧ����Ϊ����������ʧ����Ҫ����������� ���ɲ�ȡ�Ĵ�ʩΪ ��
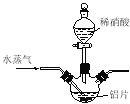
��3���¶ȸ���200��ʱ����������ȫ�ֽ������������������(�������Ϊ4:1)���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4��������ͼ��ʾʵ��װ����ȡAl(NO3)3��ͨ��ˮ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2�����ش��������⣺
��1��B2A4������Bԭ�ӹ�����ӻ�����Ϊ ��B2A4�����ЦҼ��ͦм�������Ϊ ��
��2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ______________����Ԫ�ط��ű�ʾ����������CA3�ķе�Ȼ�����BA4�ĸߣ�����Ҫԭ���� ��
��3��Ԫ��B��һ����������Ԫ��C��һ�������ﻥΪ�ȵ����壬Ԫ��C������������ķ���ʽ�� ��
��4��Ԫ��E���γɶ��������磺E(CO)5�ȡ�
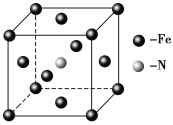
�ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ ��
��E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������� ��������ͣ����þ�����E�Ļ��ϼ�Ϊ ��
��5��E��C�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ����Ļ�ѧʽΪ_______�������������Eԭ�Ӽ�ľ���Ϊacm����þ�����ܶ���______g��mL-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�131.4�����۵�9.79����������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2���������������з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����
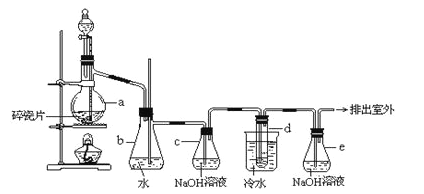
����д���пհף�
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�������Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170������������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ��
��2��д���Ʊ�1��2����������Ļ�ѧ����ʽ�� ��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е����� ��
��4������c��NaOH��Һ�������ǣ� ��
��5���жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�A��B��C��D��E��FΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ��������������AԪ�صĵ����ǿ�������Ҫ�ɷ֣�Bԭ�Ӻ���p�������1�ԳɶԵ��ӣ�DԪ�صļ۵������������������һ�룬C��Bͬ���壬A��Fͬ���壬D��Eͬ�塣�ش��������⣺
��1��A��B��C��һ�������ɴ�С��˳��Ϊ�� ����Ԫ�ط��ű�ʾ����
��2��B��C�γɵĶ�Ԫ�������У����ڷǼ��Է��ӵ��ǣ� ���ѧʽ�����÷�������ԭ�ӵ��ӻ�����Ϊ�� ��
��3��A��CԪ���γɵij����������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ4������ �����ѧʽ����ͬ�������ƽ�������ε����� ��
��4��E��F�γɵ�һ�ֻ�����ľ���ṹ��ͼ��ʾ����û�����Ļ�ѧʽΪ ��F����λ��Ϊ ��
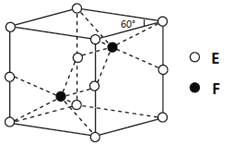
��5��D�����ӿ����γɶ���������Dn+��Br-��C��
��ۺ��������A�ļ��⻯���γɵ�1:1:1:5��ij
���������������Һ�еμ�AgNO3��Һ����
����ɫ�������μ�BaCl2��Һ��������������Ļ�ѧʽΪ�� ��nֵΪ ��Dn+�Ļ�̬�����Ų�ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298 Kʱ,�ϳɰ���Ӧ:N2(g)+3H2(g)![]() 2NH3(g),����2 mol NH3�ų�92.4 kJ�������ڸ��¶���,ȡ1 mol N2(g)��3 mol H2(g)�����Ϊ2L���ܱ������г�ַ�Ӧ,�ų������� (����ڡ������ڡ���С�ڡ�)92.4 kJ��ԭ����
2NH3(g),����2 mol NH3�ų�92.4 kJ�������ڸ��¶���,ȡ1 mol N2(g)��3 mol H2(g)�����Ϊ2L���ܱ������г�ַ�Ӧ,�ų������� (����ڡ������ڡ���С�ڡ�)92.4 kJ��ԭ����
�����Ӧ5���Ӵﵽƽ��ʱ���������ʵ���Ϊ2.5mol�������ʱ���������ķ�Ӧ����Ϊ ,��ƽ��ʱ������ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҳ��ü���װ��ģ����ʾ��ҵ����ԭ����ʵ��װ��ͼ��ʵ�鲽�����£�
![]()
![]()
![]()
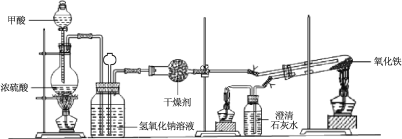
�� ����ͼ���Ӻ�װ�ã����װ�������ԡ�
�� ��ȡ���� Fe2O3��ʯӢ�Թ��У���ȼ�����ƾ��ƣ�����������ᡣ
�� �����ij�������ȼ���������ƾ��ơ�
�� 30 min��Ϩ��ƾ��ƣ��رյ��ɼС�
�� ��������ȴ�����º��ռ����
�� �������Ϸ����ֱ��ռ����������־ƾ��ƣ��������ֿ��Լ��л��桢����¶ȣ��;ƾ���Ƽ��ȵIJ��
��ش��������⣺
��1���Ʊ�CO��ԭ�������ü��ᣨHCOOH����Ũ������������µķֽ��Ƶã�ʢ�ż������������Ϊ ���÷�Ӧ�Ļ�ѧ����ʽ ��
��2��ʵ�鲽����ij�������ָ ��
��3��ʵ�鲽����Ϩ��ƾ��Ƶ�˳��Ϊ______________������I��II��III��
��4��ͨ�������ϻ�ȡ������Ϣ��
I���ƾ���ƽ���¶�Ϊ600���������־ƾ���ƽ���¶�Ϊ700�����ƾ����ƽ���¶�Ϊ930����
II������ָ������Ӧ�¶ȸ���710����Fe���ȶ����ڣ�680����710��֮�䣬FeO�ȶ����ڣ�����680��������Ҫ��Fe3O4���Է����ƾ��Ƽ�������������Fe��ԭ���� ��
��5����֪FeO��Fe2O3��Fe3O4��Ԫ�ص����������ֱ�Ϊ��22.2%��30%��27.6%�����������������3����Ʒ����Ԫ�������Ԫ�ص������������±���
���ȷ�ʽ | ����Ԫ����� | ��Ԫ�ص���������%[��������] | |
Fe | O | ||
�ƾ��� | Fe��O | 74.50 | 25.50 |
�����־ƾ��� | Fe��O | 76.48 | 23.52 |
�ƾ���� | Fe | 100.00 | 0.00 |
������Ԫ�ص�����������֪ǰ���ּ��ȷ�ʽ�õ��IJ���Ϊ�������оƾ��Ƽ������ò������������_______�ֿ��ܡ�
��6��ͨ����һ���������������ǰ���ּ��ȷ�ʽ�õ��Ĺ����ĩ�ɷ־�ΪFe3O4��Fe���þƾ���Ƽ��ȵõ��Ĺ����ĩ�ɷ�ΪFe����������þƾ��Ƽ��ȷ�ʽ�������Fe3O4��Fe��������Ϊ_____����Ҫ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2��ѧ�뼼����
������Ȼ��ֲ��㷺���ڹ�ҵ��ũҵ�����Ƽ�������ҪӦ�á�
�ش��������⣺
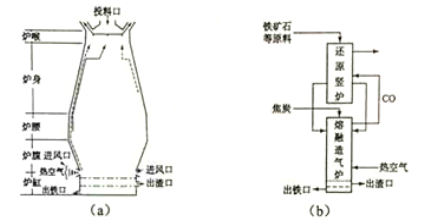
��1��������ʯ��������ұ�������ĸ�¯��ͼ��a����ʾ��ԭ���г�����ʯ�ͽ�̿�⺬�� ����ȥ����ʯ����ʯ����Ҫ�ɷ�ΪSiO2 ���Ļ�ѧ��Ӧ����ʽΪ �� ����¯�ų��������Ҫ�ɷ���N2��CO2 �� (�ѧʽ)��
��2����֪����Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ��H=+494kJ��mol-1
��CO(g)+O2(g)=CO2(g) ��H=-283kJ��mol-1
��C(s)+O2(g)=CO(g) ��H=-110kJ��mol-1
��ӦFe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) �Ħ�H= kJ��mol-1�������Ϸ�Ӧ �ų����������Թ�����Ӧ ���������������������ʽ�����
��3��������Ƴ����������ڻ�ԭ�����������գ���������ͼ(b)��ʾ�����У���ԭ��¯�൱�ڸ�¯��
���֣���Ҫ��Ӧ�Ļ�ѧ����ʽΪ ����������¯�൱�ڸ�¯�� ���֡�
��4������ʯ�г�������ʹ��¯���л���SO2 ��Ⱦ��������SO2 �ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ͻ������������������ע���ȵ㻰�⡣��ش��������⣺
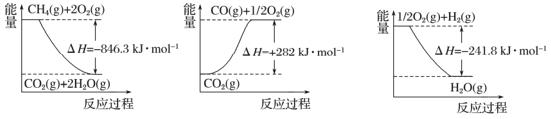
����Ŀǰ����̼���á�����Ϊ��ѧ���о�����Ҫ���⡣��������������һ���Ƚ������ⷽ�����䷴Ӧ����ʽΪCH4(g) +H2O (g) =CO (g) +3H2(g) ��
�Ķ���ͼ������÷�Ӧ�ķ�Ӧ����H=____________kJ��mol-1��
�����ռ�������CO2�ǻ����������ȵ���⡣
500��ʱ�����ݻ�Ϊ1L���ܱ������г���1 mol CO2��3 mol H2���������·�Ӧ��C02(g) +3H2 (g) =CH3OH (g) +H2O (g) ��H��0�����CO2��CH3OH��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
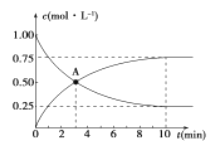
��1�� 0~10 min��v(H2)=_____________�� A�㺬����_____________���÷�Ӧƽ�ⳣ������ʽK=____________��
��2����Ӧ��500���ﵽƽ��ı䷴Ӧ�¶�ΪT�� CH3OH��Ũ����ÿ����0. 030 mol/L������5 min�ִﵽ��ƽ�⡣T______(�>������<����=��)500�����ж�������_____________��
��3���¶�ΪTʱ����Ӧ�ﵽƽ�����Ӧ�������ݻ�����һ����ƽ����____________(��������桱)��Ӧ�����ƶ����ж�������____________��
�����绯ѧ������SO2��Ŀǰ�о����ȵ㡣
����˫��ˮ����SO2������SO2��Ⱦ�����װ����ͼ��ʾ��

��1��ʯī1Ϊ___________(�������������)�������ĵ缫��ӦʽΪ____________��
��2����11.2 L(��״��)SO2���뷴Ӧ����Ǩ��H+�����ʵ���Ϊ____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com