
【题目】【加试题】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:

(1)写出反应Ⅰ的离子方程式: (任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是 ,可采取的措施为 。
(3)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是 。
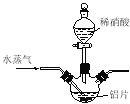
(4)若用右图所示实验装置制取Al(NO3)3,通入水蒸气的作用是 。
【答案】(1)2Al+2OH—+2H2O=2AlO2—+3H2↑(或Al2O3 + 2OH—=2AlO2— + H2O)
(2)如何控制反应终点(或硝酸的用量) 将加入稀硝酸改为通入过量CO2
(3)4Al(NO3)3![]() 2Al2O3+12NO2↑+3O2↑
2Al2O3+12NO2↑+3O2↑
(4)升高温度、搅拌,加快反应速率
【解析】
试题分析:(1)反应Ⅰ涉及:铝与氢氧化钠反应生成偏铝酸钠与氢气,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+H2O;
(2)硝酸属于强酸,可以溶解氢氧化铝沉淀,导致Al元素损失,需要解决的问题是:如何控制反应终点(或硝酸的用量),可以将加入稀硝酸改为通入过量CO2,避免氢氧化铝沉淀溶解;
(3)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体,两种气体应是二氧化氮与氧气,二者体积之比为4:1,满足原子守恒与电子转移守恒,反应方程式为:4Al(NO3)3![]() 2Al2O3+12NO2↑+3O2↑;
2Al2O3+12NO2↑+3O2↑;
(4)由于水蒸气温度较高,可以升高反应体系的温度,且可以起搅拌作用,可以加快反应速率。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应2NO2+2NaOH═NaNO3+NaNO2+H2O,含0.2mol NaOH水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1)可使溶液A和溶液B的pH值相等的方法是 。
a、向溶液A中加适量水 b、向溶液A中加适量NaOH
c、向溶液B中加适量水 d、向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:

(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体.甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡.甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O(g) △H=Q1kJmol﹣1
CH3OH(l)+H2O(g) △H=Q1kJmol﹣1
又查资料得知:①CH3OH(l)+1/2O2(g)![]() CO2(g)+2H2(g) △H=Q2kJmol﹣1
CO2(g)+2H2(g) △H=Q2kJmol﹣1
②H2O(g)=H2O(l)△H=Q3kJmol﹣1,则表示甲醇的燃烧热的热化学方程式为 。
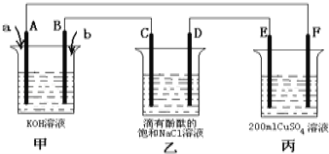
(2)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置.已知:A、B、C、D、E、F都是惰性电极,丙中为0.1mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色.回答下列问题:
①a物质是 ,A电极的电极反应式为 。
②乙装置中的总化学反应方程式为 。
③当乙装置中C电极收集到224mL(标况下)气体时,丙中溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成:
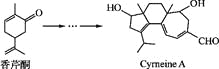
下列说法不正确的是( )
A. 香芹酮的分子式为C10H14O
B. Cyrneine A可以发生加成反应、消去反应和氧化反应
C. 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D. 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1
CO(g)+H2O(g) ΔH1
反应2:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
反应3:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图l所示。反应1、3的活化能如图2所示。
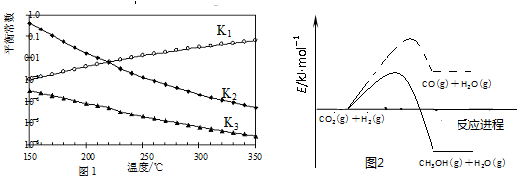
(1)则ΔH2________ΔH3(填“大于”、“小于”或“等于”),理由是________。
(2)反应1中ΔS1______0(填>、=或<=),指出有利于自发进行的温度条件____(填“较高温度”或:“较低温度”)
(3)将体积比为1:1的H2和CO2充入容积可变密闭容器内,若只进行反应1,下列措施中能使平衡时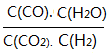 增大的是____________(填序号)
增大的是____________(填序号)
A.升高温度B.增大压强C.充入一定量的CO2 D.再加入一定量铁粉
(4)为了提高CO2和H2制备甲醇生产效率和产量;工业生产中通常采取的措施是____________
(5)在温度为300℃时,使-定量合适体积比为的H2和CO2在体积恒定的密闭容器内进行反应。该温度下反应2进行程度很小可看成不进行,请在图3中画出CO、CH3OH浓度随时间变化至平衡的定性曲线图。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液)。
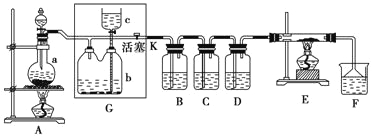
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为______。
(2)如何检查装置G的气密性:______(写出操作方法和现象)。
(3)G中b瓶内宜加入的液体是______;实验开始后B中的现象是______,C中的现象是______,F的现象是______。
(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com