
【题目】有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
【答案】(1)C:0.15mol H:0.4mol(2)C3H8O
【解析】
试题分析:(1)3g A燃烧产生的水质量是3.6g,则n(H)=(3.6g÷18g/mol)×2=0.4mol;产生的CO2物质的量是:n(CO2)=4.4g÷44g/mol=0.1mol;
(2)反应消耗的氧气的质量是:m(O2)=![]() ×32g/mol=6.4g,则反应产生的CO的质量是:m(CO)=(3g+6.4g)-(3.6g+4.4g)=1.4g。n(CO)=1.4g÷28g/mol=0.05mol,则有机物中含有的O的物质的量是:n(O)=[ 3g —(0.05mol+0.1mol)×12g/mol-0.4mol×1g/mol]÷16g/mol=0.05mol。所以n(H):n(C):n(O)=0.4mol:0.15mol:0.15mol,分子式为C3H8O。
×32g/mol=6.4g,则反应产生的CO的质量是:m(CO)=(3g+6.4g)-(3.6g+4.4g)=1.4g。n(CO)=1.4g÷28g/mol=0.05mol,则有机物中含有的O的物质的量是:n(O)=[ 3g —(0.05mol+0.1mol)×12g/mol-0.4mol×1g/mol]÷16g/mol=0.05mol。所以n(H):n(C):n(O)=0.4mol:0.15mol:0.15mol,分子式为C3H8O。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式 甲: 乙: C: H: 。
(2)写出反应⑦的离子方程式: ________。
(3)要除去物质F中的物质G,可行的方法是( )
A.滴入KSCN溶液 B.通入足量的氯气 C.滴入NAOH溶液 D.加入过量铁粉
(4)若将D溶液滴入F溶液中,将其长时间露置于空气中观察到的现象为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
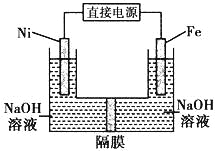
A. 镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:

(1)写出反应Ⅰ的离子方程式: (任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是 ,可采取的措施为 。
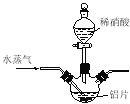
(3)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是 。
(4)若用右图所示实验装置制取Al(NO3)3,通入水蒸气的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33-36 |
| 易溶于甲醇、乙醚,微溶于水 |
反应结束后,先分离出甲醇,再加入乙醚进行萃取。
(1)①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。化合物有E最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯.玉米淀粉等发酵制得,E的钙盐是人们喜爱的补钙剂之一。
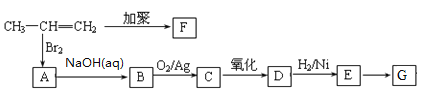
已知:![]()
(1)D中所含官能团名称。E→G的反应类型为_________。
(2)聚合物F的结构简式。聚合物G的结构简式_________
(3)在一定条件下,两分子E在浓硫酸作用下形成一种六元环状化合物,该化合物的结构简式是_________。
(4)B转化为C的化学反应方程式是_________。
(5)下列四种化合物与E互为同分异构体的是_________。
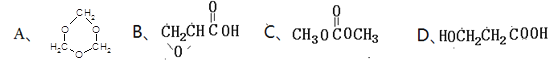
查看答案和解析>>
科目:高中化学 来源: 题型:
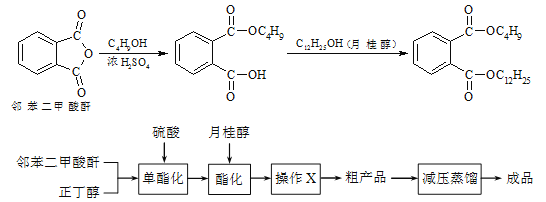
【题目】邻苯二甲酸丁基月桂酯是一种淡黄色透明油状液体,密度约0.97g/cm3,常用作聚氯乙烯等树脂的增塑剂。工业上生产原理和工艺流程如下:
有关物质的物理性质见下表:
化合物 | 溶解性 | 熔点 | 沸点 |
邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |
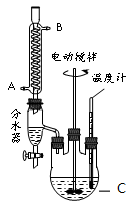
某实验小组的同学模拟工业生产的工艺流程,用右图所示装置制取少量邻苯二甲酸丁基月桂酯,图中夹持和加热装置已略去。主要操作步骤如下:
①向三颈烧瓶内加入30 g 邻苯二甲酸酐、16 g 正丁醇以及少量浓硫酸。
②搅拌,升温至105 ℃,持续搅拌反应1小时。
③冷却至室温,加入40 g 月桂醇,升温至160 ℃,搅拌、保温至反应结束。
④冷却至室温,将反应混合物倒出。
⑤通过工艺流程中的操作X,得到粗产品。
请回答下列问题:
(1)仪器C的名称___________。冷凝管中冷水应从___________进。
(2)步骤③中判断反应已结束的方法是___________。
(3)步骤⑤中操作X可除去少量未反应的邻苯二甲酸酐及正丁醇,操作X包括___________。
(4)工艺流程中减压蒸馏的目的是___________。
(5)实验结果表明步骤②、③产率都比较高,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)B2A4分子中B原子轨道的杂化类型为 ,B2A4分子中σ键和π键个数比为 。
(2)A、B、C、D四种元素的电负性从大到小的顺序为______________(用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是 。
(4)元素E能形成多种配合物,如:E(CO)5等。
①基态E原子的价电子排布图为 。
②E(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于 (填晶体类型),该晶体中E的化合价为 。
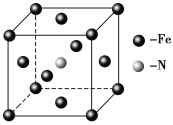
(5)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为_______。若两个最近的E原子间的距离为acm,则该晶体的密度是______g·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
![]()
![]()
![]()
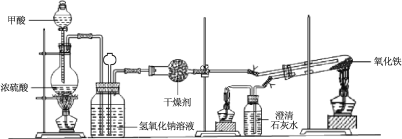
① 按上图连接好装置,检查装置气密性。
② 称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③ 在完成某项操作后,点燃另外两处酒精灯。
④ 30 min后熄灭酒精灯,关闭弹簧夹。
⑤ 待产物冷却至室温后,收集产物。
⑥ 采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数%[§科§网] | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____。(要求保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com