
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
【答案】D
【解析】试题分析:A、由于羟基的影响,苯环上与羟基相邻的碳原子上的氢和对位上的氢变得活泼,容易发生取代,丁香酚结构中羟基的一个邻位和对位没有氢,只有一个邻位有氢,能与1molBr2发生取代,丁香酚含有一个碳碳双键,碳碳双键和1molBr2发生加成反应,因此1mol丁香酚能与2molBr2反应,错误;B、丁香酚含有酚羟基,因此丁香酚与FeCl3溶液发生显色反应,错误;C、1mol香兰素中含有1mol苯环,1mol苯环能与3molH2反生加成反应,1mol香兰素还含有1mol醛基,1mol醛基能与1molH2发生加成,总共消耗4molH2,错误;D、苯是平面正六边形其中6个碳和6个氢共面,香兰素中苯环上的6个碳和3个氢共面,-OH中氧取代苯环上的氢,-OH中氧跟苯环共面,-CHO中碳取代苯环上的氢,醛基中的碳跟苯环共面,-OCH3中氧取代苯环上的氢,氧跟苯环共面,因此至少12个原子共面,正确。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。请回答下列问题:

(1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是 热反应, Ba(OH)28H2O与NH4Cl的反应是 热反应.反应过程 (填“①”或“②”)的能量变化可用图2表示。
(2)现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
以上两个反应能设计成原电池的是 , 负极材料为:____ ___,电解质溶液为:_______ ___,负极的电极反应式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国著名的化学家侯德榜先生(下图)改革国外的纯碱生产工艺,生产流程表示如下:

![]()
(1)沉淀池中发生的化学反应方程式是
________________________________________________________________________
________________________________________________________________________。
(2)写出上述流程中X物质的分子式________。
(3)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________。
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________________。
(5)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有________(填编号字母)。
(a)增大NH的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为
(2)玻璃棒有多种用途,下列实验操作中玻璃棒的作用完全相同的是 (填字母)
①测定醋酸钠溶液的pH ②加热食盐溶液制备NaCl晶体
③配制0.1mol/L的硫酸溶液 ④用淀粉—KI试纸检验溶液中氧化性离子
⑤配制10%的硫酸钠溶液
A.①⑤ B.②⑤ C.①④ D.③④
(3)水洗时检验TiO2·x H2O已洗净的方法是
(4)下列可用于测定TiO2粒子大小的方法是 (填字母代号)
a.核磁共振氢谱 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(5)滴定终点的现象是
(6)滴定分析时,称取TiO2(摩尔质量为Mg·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为 %
(7)下列操作会导致TiO2质量分数测定结果偏高的是
A. 滴定终点读取滴定管刻度时,俯视标准液液面
B. 配制标准溶液时,烧杯中的NH4Fe(SO4)2溶液有少量溅出
C. 容量瓶清洗之后,未干燥
D.配制标准溶液定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
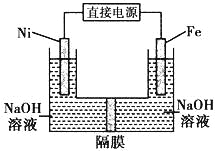
A. 镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢青蒿素而获2015年诺贝尔生理学或医学奖,震惊世界,感动中国。已知青蒿素的一种化学部分工艺流程如下:
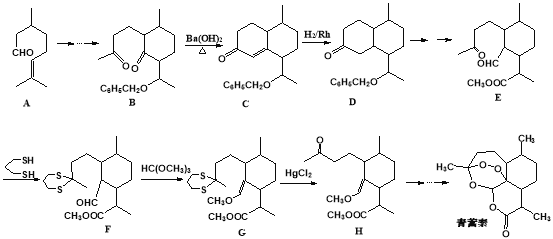
已知: 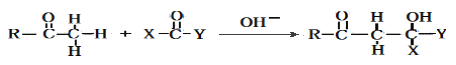
(1)下列有关说法中正确的是______________
A.青蒿素遇湿润的淀粉碘化钾试纸立刻显蓝色,是因为分子结构中含有酯基
B.青蒿素易溶于水,难溶于乙醇、苯等
C.青蒿素属于环状化合物,但不属于芳香族化合物
D.一定条件下,青蒿素能与氢氧化钠溶液反应
(2)化合物A中含有的非含氧官能团的名称是________________________,请选择下列合适的试剂来检验该官能团,试剂加入的正确顺序为_______________。
A.溴水 B.稀盐酸 C.新制氢氧化铜悬浊液 D.氢氧化钠溶液
(3)该工艺流程中设计E→F、G→H的目的是________________________ 。
(4)反应B→C,实际上可看作两步进行。试根据已知信息写出依次发生反应的反应类型是_______________、________________。
(5)M与A互为同系物,但比A少两个碳原子。满足下列条件的M的同分异构体有___种(不考虑立体异构)。① 含有六元环 ②能发生银镜反应
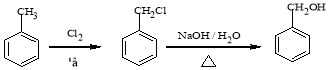
(6)请结合所学知识和上述信息,写出由苯甲醛和氯乙烷为原料(无机试剂任用),制备苄基乙醛(![]() )的路线流程图。路线流程图示例如下:
)的路线流程图。路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:

(1)写出反应Ⅰ的离子方程式: (任写一个)。
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是 ,可采取的措施为 。
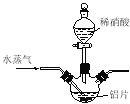
(3)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是 。
(4)若用右图所示实验装置制取Al(NO3)3,通入水蒸气的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。化合物有E最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯.玉米淀粉等发酵制得,E的钙盐是人们喜爱的补钙剂之一。
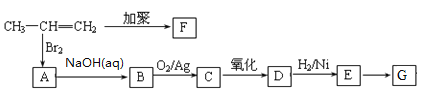
已知:![]()
(1)D中所含官能团名称。E→G的反应类型为_________。
(2)聚合物F的结构简式。聚合物G的结构简式_________
(3)在一定条件下,两分子E在浓硫酸作用下形成一种六元环状化合物,该化合物的结构简式是_________。
(4)B转化为C的化学反应方程式是_________。
(5)下列四种化合物与E互为同分异构体的是_________。
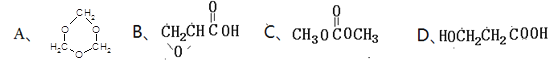
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2﹣二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用如图所示装置制备1,2﹣二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液。试管d中装有浓溴水(表面覆盖少量水)。
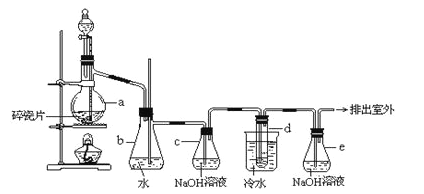
请填写下列空白:
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易发生副反应.请写出乙醇发生消去反应的方程式 。
(2)写出制备1,2﹣二溴乙烷的化学方程式: 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请回答发生堵塞时瓶b中的现象: 。
(4)容器c中NaOH溶液的作用是: 。
(5)判断该制备反应已经结束的最简单方法是___________________________;
(6)若产物中有少量副产物乙醚,可用__________的方法除去;
(7)反应过程中应用冷水冷却装置d,其主要目的是___________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com