
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2 。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为
(2)玻璃棒有多种用途,下列实验操作中玻璃棒的作用完全相同的是 (填字母)
①测定醋酸钠溶液的pH ②加热食盐溶液制备NaCl晶体
③配制0.1mol/L的硫酸溶液 ④用淀粉—KI试纸检验溶液中氧化性离子
⑤配制10%的硫酸钠溶液
A.①⑤ B.②⑤ C.①④ D.③④
(3)水洗时检验TiO2·x H2O已洗净的方法是
(4)下列可用于测定TiO2粒子大小的方法是 (填字母代号)
a.核磁共振氢谱 b.红外光谱法 c.质谱法 d.透射电子显微镜法
(5)滴定终点的现象是
(6)滴定分析时,称取TiO2(摩尔质量为Mg·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为 %
(7)下列操作会导致TiO2质量分数测定结果偏高的是
A. 滴定终点读取滴定管刻度时,俯视标准液液面
B. 配制标准溶液时,烧杯中的NH4Fe(SO4)2溶液有少量溅出
C. 容量瓶清洗之后,未干燥
D.配制标准溶液定容时,俯视刻度线
【答案】(1)TiCl4+(2+x) H2O![]() TiO2·xH2O↓+4HCl (2)BC
TiO2·xH2O↓+4HCl (2)BC
(3)取少量最后一次水洗液,滴加AgNO3溶液,不产生白色沉淀,说明沉淀已洗净
(4)d (5)溶液变成红色且半分钟内不褪色 (6)![]() (7)B
(7)B
【解析】
试题分析:(1)设TiCl4的系数为1,根据元素守恒,TiO2xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),化学方程式为TiCl4+(2+x) H2O![]() TiO2·xH2O↓+4HCl;
TiO2·xH2O↓+4HCl;
(2)①测定醋酸钠溶液的pH,玻璃棒蘸取溶液滴在pH试纸上测定;②加热食盐溶液制备NaCl晶体,玻璃棒搅拌避免局部受热固体飞溅;③配制O.1mol/L的H2SO4溶液,搅拌引流作用;④用KI淀粉试纸检验溶液中氧化性离子,玻璃棒蘸取溶液滴在KI淀粉试纸上测定;⑤配制10%的硫酸钠溶液,玻璃棒搅拌加速溶解;所以②⑤和①④符合,答案选BC。
(3)沉淀吸附溶液中的Cl-,根据反应:Cl-+Ag+═AgCl↓,取少量洗涤液,检验溶液中是否还存在Cl-即可,方法是取少量最后一次水洗液,滴加AgNO3溶液,不产生白色沉淀,说明沉淀已洗净。
(4)核磁共振谱用于测有机物中含有多少种氢原子;红外光谱分析有机物含有何种化学键和官能团;质谱法常用于测有机物相对分子质量;透射电子显微镜可以观察到微粒的大小,答案选d。
(5)Fe3+与Ti3+反应,被还原为Fe2+,加入KSCN不显红色,当达到滴定终点时,再加入NH4Fe(SO4)2,溶液中Fe3+过量,会变成红色,所以滴定终点的现象是溶液变成红色且半分钟内不褪色。
(6)根据得失电子守恒,有:1Ti3+~1Fe3+,所以n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,质量分数为:![]() %。
%。
(7)A. 滴定终点读取滴定管刻度时,俯视标准液液面,导致末读数据读小了,标准液的体积偏小,测定结果偏低,错误;B. 配制标准溶液时,烧杯中的NH4Fe(SO4)2溶液有少量溅出,物质的量浓度减小,消耗的体积增大,测定结果偏高,正确;C. 容量瓶清洗之后,未干燥对测定结果无影响,错误;D.配制标准溶液定容时,若俯视刻度线,溶液体积比实际体积偏小,所配溶液浓度偏大,导致消耗标准液的体积偏小,测定结果偏低,错误;答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各小题。
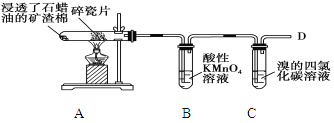
(1)碎瓷片的作用是_____________。
(2)B中现象是________,乙烯发生_______反应。
(3)C中现象是________,发生反应的化学方程式______________________。
(4)在D处点燃时必须进行的操作是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni和Fe在工业生产和新型材料领域有广泛的应用,黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制硫酸;回答下列问题:
(1)将FeS2与稀盐酸所对应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________;
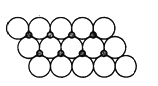
(2)FeS2的晶体中的Fe2+离子的排列方式如下图所示:

①每个Fe2+周围最近的等距离的S22-离子有________个;
②已知FeS2的晶胞参数是a0=54nm,它的密度为_____________gcm-3;(列式并计算,阿伏加德罗常数为6.02×1023)。
(3)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为___________(用含有a的代数式表示)。在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为________g(氧离子的半径为1.40×10-10m,![]() =1.732)。
=1.732)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在NaCl溶液中滴加AgNO3溶液, 反应的离子方程式为:__________________
(2)在CH3CH2CH2Cl中滴加AgNO3溶液,现象为_______________________________
(3)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
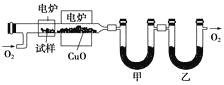
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12 g有机物X的蒸气氧化产生7.04 g二氧化碳和1.80 g水。
步骤二:通过仪器分析得知X的相对分子质量为106。
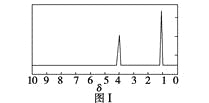
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3。如图Ⅰ。
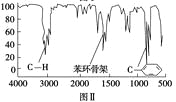
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ。
试填空:
(1)X的分子式为________;X的习惯命名为 。
(2)步骤二中的仪器分析方法称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:

(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)已知:H2(g)+1/2O2(g)═H2O(g) △H1= —241.8 kJmol-1
2C(s)+O2(g)═2CO(g) △H2= —221 kJmol-1
由此可知焦炭与水蒸气反应的热化学方程式为
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到两组数据
CO2(g)+H2(g) ΔH,得到两组数据
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
该反应的![]() H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
(4)一定条件下,某密闭容器中已建立A(g)+B(g)![]()
C(g)+D(g) △H>0的化学平衡,时间速率图像如右图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是
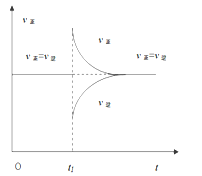
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V (NO2)= 。

(6)在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。

有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成:
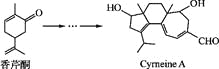
下列说法不正确的是( )
A. 香芹酮的分子式为C10H14O
B. Cyrneine A可以发生加成反应、消去反应和氧化反应
C. 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D. 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为工业合成氨生产简易流程图:
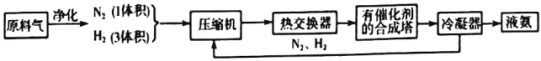
回答下列问题:
(1)合成氨所需的氮气来源于__________;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如下表:
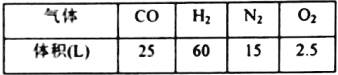
计算该富氧空气中O2和N2的体积比V(O2):V(N2)=__________。
(2)在合成氨的原料气中混有的杂质必须除去的原因是__________;
上述流程中热交换器的作用是__________。从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨。为提高原料的利用率,通常采取的措施是__________。
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快,②__________。
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):__________。
②氨基甲酸铵受热分解为尿素与水:__________。
(5)新法合成氨常采用电解法合成。即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率,新法合成氨所用的电解质能传导H+,则阴极的电极反应式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com