
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�A��B��C��D��E��FΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ��������������AԪ�صĵ����ǿ�������Ҫ�ɷ֣�Bԭ�Ӻ���p�������1�ԳɶԵ��ӣ�DԪ�صļ۵������������������һ�룬C��Bͬ���壬A��Fͬ���壬D��Eͬ�塣�ش��������⣺
��1��A��B��C��һ�������ɴ�С��˳��Ϊ�� ����Ԫ�ط��ű�ʾ����
��2��B��C�γɵĶ�Ԫ�������У����ڷǼ��Է��ӵ��ǣ� ���ѧʽ�����÷�������ԭ�ӵ��ӻ�����Ϊ�� ��
��3��A��CԪ���γɵij����������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ4������ �����ѧʽ����ͬ�������ƽ�������ε����� ��
��4��E��F�γɵ�һ�ֻ�����ľ���ṹ��ͼ��ʾ����û�����Ļ�ѧʽΪ ��F����λ��Ϊ ��
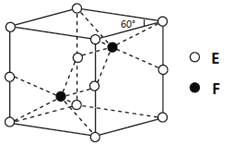
��5��D�����ӿ����γɶ���������Dn+��Br-��C��
��ۺ��������A�ļ��⻯���γɵ�1:1:1:5��ij
���������������Һ�еμ�AgNO3��Һ����
����ɫ�������μ�BaCl2��Һ��������������Ļ�ѧʽΪ�� ��nֵΪ ��Dn+�Ļ�̬�����Ų�ʽΪ�� ��
���𰸡���1��N��O��S��2�֣���2��SO3��1�֣� sp2��1�֣���3��H2SO3��H2SO4 ��2�֣� HNO3��1�֣�
��4��NiAs��2�֣� 6��1�֣�
��5��[CoSO4(NH3)5]Br��2�֣� 3��1�֣�1s22s22p63s23p63d6��[Ar]3d6��2�֣�
�����������������A��B��C��D��E��FΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ��������������Bԭ�Ӻ���p�������1�ԳɶԵ��ӣ���Χ�����Ų�Ϊns2np4��������A�壬AԪ�صĵ����ǿ�������Ҫ�ɷ֣�ԭ������С��B����AΪNԪ�أ�����C��Bͬ���塢A��Fͬ���壬F��ԭ����������C����F��C���ܴ���ͬ���ڣ�FӦ����C����һ���ڣ���B��C��F�ֱ�Ϊ�������������ڣ���BΪOԪ�ء�CΪSԪ�ء�FΪAs��D��Eͬ�壬D��Eԭ����������S��С��As��ֻ��Ϊ����Ԫ�أ�DԪ�صļ۵������������������һ�룬�۵�����Ϊ(2+8+8)��2=9����DΪCo����EΪNi��
��1��ͬ������ԭ����������һ�����ܳ��������ƣ���NԪ��2p�ܼ�����3�����ӣ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ�ͬ�������϶��µ�һ�����ܼ�С���ʵ�һ�����ܣ�N��O��S��
��2��B��C�γɵĶ�Ԫ��������SO2��SO3��SO2������Sԭ�ӹµ��Ӷ���Ϊ(6-2��2)/2=1���۲���Ӷ���Ϊ2+1=3��ΪV�νṹ������������������IJ��غϣ����ڼ��Է��ӣ�SO3������Sԭ�ӹµ��Ӷ���Ϊ(6-2��3)/2=0���۲���Ӷ���Ϊ3+0=3��Ϊƽ���������νṹ��������������������غϣ����ڷǼ��Է��ӣ�Sԭ�Ӳ�ȡsp2�ӻ���
��3��A��CԪ���γɵij����������������ᡢ���ᡢ�����ᡢ���ᣬ���ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ4������H2SO3��H2SO4��������е�Ԫ�صļ۲���Ӷ�����3���Ҳ����ڹ¶Ե��ӣ���������ƽ�������ε��������ᣬ��ѧʽΪHNO3��
��4��EΪNi��FΪAs���ɾ����ṹ��֪�������к���2��Asԭ�ӣ�����Niԭ����ĿΪ8��1/8+4��1/4=2���ʸû����ﻯѧʽΪNiAs��Fԭ������Χ��6��Eԭ���γ����ڣ�F��λ��Ϊ6��
��5��C����ۺ������ΪSO42-��A�ļ��⻯��ΪNH3����Con+��Br-��SO42-��NH3�γɵ�1��1��1��5��ij�����ɵ���غ��֪n=3��Con+ΪCo3+�������������Һ�еμ�AgNO3��Һ��������ɫ�������μ�BaCl2��Һ������˵��������������ڽ磬������Ϊ��������磬���Ը�����ﻯѧʽʽΪ[Co(SO4)(NH3)5]Br��Co3+�Ļ�̬�����Ų�ʽΪ1s22s22p63s23p63d6��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿�״��ֳ���ľ��������ľ�������е�64.7��������ɫ�оƾ���ζ�ӷ���Һ�壮�״��ж�������5��10mL��˫Ŀʧ�����������ûᵼ���������״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ�Һ��ȼ�ϣ������������ȩ��ũҩ�����������л������ȡ���;ƾ��ı��Լ�����
��1����ҵ�Ͽ�����CO2��H2�����״�������ʽ���£�
CO2��g��+3H2��g��![]() CH3OH��l��+H2O(g) ��H=Q1kJmol��1
CH3OH��l��+H2O(g) ��H=Q1kJmol��1
�ֲ����ϵ�֪����CH3OH��l��+1/2O2��g��![]() CO2(g)+2H2(g) ��H=Q2kJmol��1
CO2(g)+2H2(g) ��H=Q2kJmol��1
��H2O��g��=H2O��l����H=Q3kJmol��1�����ʾ�״���ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
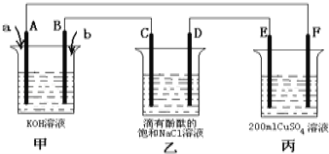
��2���״�ȼ�ϵ���Ƿ�����ɫ��ѧ���������ȼ�ϵ�أ���ͼ���Լ״�ȼ�ϵ�أ��׳أ�Ϊ��Դ�ĵ��װ�ã���֪��A��B��C��D��E��F���Ƕ��Ե缫������Ϊ0.1mol/L CuSO4��Һ �����跴Ӧǰ����Һ������䣩������׳�ͨ������a��bʱ��D�������ʺ�ɫ���ش��������⣺
��a������ ��A�缫�ĵ缫��ӦʽΪ ��
����װ���е��ܻ�ѧ��Ӧ����ʽΪ ��
������װ����C�缫�ռ���224mL������£�����ʱ��������Һ��pH= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ�ʳƷ���ϵ��л�������A������Է�������Ϊ120��Aȼ��ֻ���ɶ�����̼��ˮ��A�ȿ������Ҵ�����������Ӧ���ֿ��������ᷢ��������Ӧ���Ҳ��A���Ҵ���ȫ���������л�����B����Է�������Ϊ176����ش��������⣺
��1��A�ķ���ʽΪ ��
��2��B�Ľṹ��ʽ ��
��3��A�����ᷢ��������Ӧ�Ļ�ѧ����ʽ ��
��4���ɱ�ϩ��������������Ժϳ��л�������A���������£�
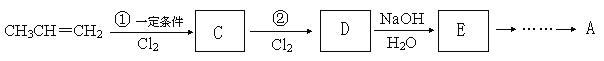
��C�ķ���ʽΪC3H5Cl��D�ķ���ʽΪC3H5Cl3����ٵķ�Ӧ����Ϊ ��
D��E��Ӧ�Ļ�ѧ����ʽΪ ��
�벹�����E��A�ķ�Ӧ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ǰ����������Ԫ��A��B��C��D��E��F�ĺ˵������������Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ������A��C���γ�AC�����ӻ�������е��������������һ�����Ӳ�.E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��FԪ�غ���������������Ѫ�쵰��Я�������Ĵ�С����ش�
��1��A��B��C��D�ĵ�һ��������С�����˳����__________(��Ԫ�ط������)
��2��������BD3�ķ��ӹ���Ϊ__________��B��ԭ�ӹ���ӻ�����Ϊ__________��BԪ���⻯��ķе������ͬ��������Ԫ�ص��⻯���ԭ����__________��
��3����֪F2+��KCN��Һ��Ӧ��F(CN)2���������������KCN��Һʱ�����ܽ⣬���������.��F�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ__________��CN-��__________(һ�ַ���)��Ϊ�ȵ�����.����CN-�綾�Եķ���֮һ�Ǽ���Ũ��˫��ˮ���ɽ���ת��Ϊ������̼���μ�������д���÷�Ӧ�����ӷ���ʽ��__________��
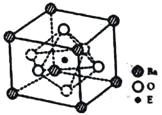
��4����E��̬ԭ�ӵļ۵����Ų�Ϊ__________����EO2��̼�ᱵ������״̬�·�Ӧ�����þ���ľ����ṹ��ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ__________��
����֪�þ����Ħ������ΪM(g/mol)������E4+������λ��Ϊ__________�����þ����߳�Ϊanm���ɼ���þ�����ܶ�Ϊ__________g/cm3(�����ӵ�����ΪNA)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȩ�����������ζ�����������ϡ�ϴ�Ӽ��ͻ�ױƷ�����ϡ��ϳ�����ȩ��·����ͼ��ʾ(�����Լ�������δע��)��

��֪��![]()
![]()
��ش��������⣺
��1��D�Ľṹ��ʽ��_______________��
��2������E�Ļ�ѧ����ʽ��___________________________________________��
��3�������й�G��������,����ȷ����______(�����)��
A��G��������4�ֲ�ͬ��ѧ��������ԭ��
B��G�ܷ�����ȥ��Ӧ��������Ӧ�ͻ�ԭ��Ӧ
C��1molG�������5molH2�����ӳɷ�Ӧ
��4��H��ͬ���칹���ж��֣���д����������������һ�ֽṹ��ʽ��__________��
����FeCl3��Һ����ɫ�����˴Ź���������������������ԭ�ӵ����շ塣
��5����F��Gת���Ĺ����У������з���ʽΪC17H22O�ĸ�����K������K�Ľ�
����ʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��һ����ȡ������������Ϊԭ�Ͻ����ض���Ӧ��װ�ã��������������������bƿ�У����и��Լ�ƿ����װ�Լ�Ϊ��B(������)��C(�⻯�ص�����Һ)��D(ˮ)��F(��ɫʯ����Һ)��
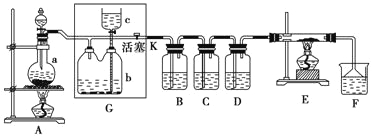
��1����A����ƿ�еĹ���ΪMnO2��Һ��ΪŨ���ᣬ���䷢����Ӧ�Ļ�ѧ����ʽΪ______��
��2����μ��װ��G�������ԣ�______��д����������������
��3��G��bƿ���˼����Һ����______��ʵ�鿪ʼ��B�е�������______��C�е�������______��F��������______��
��4��Eװ����Ӳ�ʲ�������ʢ��̿�ۣ���E�з���������ԭ��Ӧ�������Ϊ������̼���Ȼ��⣬д��E�з�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��BPA�Ľṹ��ʽ������ͼ��ʾ�������������������Ͼ�̼������

��1�������ʵķ���ʽΪ___________�����������ŵ�������_________������____�ࡣ
��2�����������_____��̼ԭ�ӹ��档
��3�����ȼ��0.1mol���л�����ĵ�O2�ڱ�״���µ����Ϊ_________��
��4�����й���BPA�������У�����ȷ����_______��
A�����Է�����ԭ��Ӧ
B����FeCl3��Һ��ɫ
C��1mol���л���������2molH2��Ӧ
D������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ������ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | A�е����� | B�е����� | C���ռ������� | D�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�Ļ���ԭ�ϣ����Ʊ�ԭ���ǣ�
![]()
![]()
���¶��Ըߵ�����»����ɸ���������������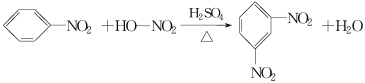
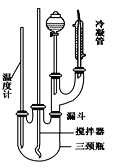
�뽫�����Ʊ���������ʵ��������д������
��1����������ƣ�ȡ100 mL�ձ�����Ũ����20 mL��Ũ����18 mL���ƻ��ᣬ���������Ϊ__________________________________
��2����װ��Ӧװ�ã���ͼ��ʾ��װʵ��װ�ã������ʵ���������ܵ������� _
��3����Ӧ���裺�ٰ�18 mL�ı����뵽����ƿ�У���������뵽��Һ©���У���εμӻ��ᣬ�ߵμӱ߽��裬��������Ŀ����____________________________ _
�ڻ���μ���Ϻ��ڼ��Ƚ���������·�Ӧ��Сʱ�����Ƽ����¶ȵķ�����___ ____ ��
�۷�����ᴿ����ȥ������û�з�Ӧ���ᣬ���ڲ����м������Һ��Ȼ���÷�Һ©����Һ��______������Ϊ�ֲ�Ʒ����ȥ��������û�з�Ӧ�ı������ɵĸ�����ļ�㷽����(�������)__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com