
����Ŀ����֪ǰ����������Ԫ��A��B��C��D��E��F�ĺ˵������������Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ������A��C���γ�AC�����ӻ�������е��������������һ�����Ӳ�.E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ��FԪ�غ���������������Ѫ�쵰��Я�������Ĵ�С����ش�
��1��A��B��C��D�ĵ�һ��������С�����˳����__________(��Ԫ�ط������)
��2��������BD3�ķ��ӹ���Ϊ__________��B��ԭ�ӹ���ӻ�����Ϊ__________��BԪ���⻯��ķе������ͬ��������Ԫ�ص��⻯���ԭ����__________��
��3����֪F2+��KCN��Һ��Ӧ��F(CN)2���������������KCN��Һʱ�����ܽ⣬���������.��F�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ__________��CN-��__________(һ�ַ���)��Ϊ�ȵ�����.����CN-�綾�Եķ���֮һ�Ǽ���Ũ��˫��ˮ���ɽ���ת��Ϊ������̼���μ�������д���÷�Ӧ�����ӷ���ʽ��__________��
��4����E��̬ԭ�ӵļ۵����Ų�Ϊ__________����EO2��̼�ᱵ������״̬�·�Ӧ�����þ���ľ����ṹ��ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ__________��
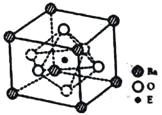
����֪�þ����Ħ������ΪM(g/mol)������E4+������λ��Ϊ__________�����þ����߳�Ϊanm���ɼ���þ�����ܶ�Ϊ__________g/cm3(�����ӵ�����ΪNA)��
���𰸡���1��Na<S<P<C1
��2��������sp3����������
��3��3d64s2��N2��CO��CN-+H2O2+OH-=CO32-+NH3��
��4����3d24s2����TiO2+BaCO3=BaTiO3+CO2������6��M��1021/a3NA
�����������������������Ŀ��������Ϣ�ƶϣ�Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ���BΪPԪ�أ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ��������ԭ����������P��ΪClԪ�أ�A��C���γ�A2C�����ӻ�������е��������������һ�����Ӳ㣬�ֱ��ƶϳ�AΪNa��CΪS��E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ����EΪTiԪ�أ�ԭ������֮��Ϊ107����FΪFeԪ�ء�
��1����һ������ͬ���ڴ����ҳ��������ƣ����е���A������A���ʴ�Ϊ��Na��S��P��Cl��
��2��PCl3�ļ۵�����=![]() =4���γ������µ��ӻ�������۵�����=�µ��Ӷ���+��λԭ���������µ��Ӷ���Ϊ1���Թ��ۼ����ų����ã������Ӽ��ܹ��γ��������PH3���Ӽ䲻���γ�������ʴ�Ϊ�������Σ�sp3�ӻ��������γ������
=4���γ������µ��ӻ�������۵�����=�µ��Ӷ���+��λԭ���������µ��Ӷ���Ϊ1���Թ��ۼ����ų����ã������Ӽ��ܹ��γ��������PH3���Ӽ䲻���γ�������ʴ�Ϊ�������Σ�sp3�ӻ��������γ������
��3��FeԪ�ص�ԭ������Ϊ26���۵�����Ϊ8��CN-�ĵȵ�����Ϊ������ԭ�ӣ��Ҽ۵�����Ϊ10�������뵽N2��CN-�ܹ���˫��ˮ����������ԭ��Ӧ����Ӧ�ķ���ʽΪCN-+H2O2+OH-=CO32-+NH3�����ʴ�Ϊ��3d64s2��N2��CN-+H2O2+OH-=CO32-+NH3����
��4����EΪTiԪ�أ���̬ԭ�ӵļ۵����Ų�Ϊ3d24s2���ʴ�Ϊ��3d24s2��
��������Baλ�ڶ��㣬8��![]() =1��Oλ������6��
=1��Oλ������6��![]() =3��Tiλ�����ģ����Ծ��廯ѧʽΪBaTiO3�����ݷ�Ӧ����������֪��ѧ����ʽΪTiO2+BaCO3=BaTiO3+CO2�����ʴ�Ϊ��TiO2+BaCO3=BaTiO3+CO2����
=3��Tiλ�����ģ����Ծ��廯ѧʽΪBaTiO3�����ݷ�Ӧ����������֪��ѧ����ʽΪTiO2+BaCO3=BaTiO3+CO2�����ʴ�Ϊ��TiO2+BaCO3=BaTiO3+CO2����
��Ti4+λ�����ģ�������λ�����ĵ�O�ڽӣ�Ti4+������λ��Ϊ6�������к���һ�������������Ϊ(a��10-7)3��Vm=NA��(a��107)3������=![]() =
=![]() ���ʴ�Ϊ��6��
���ʴ�Ϊ��6��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ�������
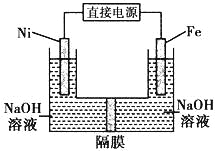
A. �����������缫��ӦΪ4OH����4eһ= O2��+ 2 H2O
B. ���ʱ�����ķ���Ϊ��������Ni�缫����Һ��Fe�缫������
C. ����ĤΪ�����ӽ���Ĥ����OH�����������ƶ�
D. ���ʱ������pH���͡�������pH���ߣ���ȥ��Ĥ��Ϻ���ԭ��Һ�Ƚ�pH���ͣ�������ǰ������仯���Բ��ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ������ᶡ���¹�����һ�ֵ���ɫ����״Һ�壬�ܶ�Լ0.97g/cm3��������������ϩ����֬�����ܼ�����ҵ������ԭ�������������£�
�й����ʵ��������ʼ��±���
������ | �ܽ��� | �۵� | �е� |
�ڱ��������� | ������ˮ�����ѣ��������ȱ����Ҵ������� | 131.6�� | 295�� |
������ | ����ˮ�������Ҵ����ѡ������л��ܼ� | -88.9�� | 117.5�� |
�¹� | ������ˮ�����ڴ����� | 24 | 259�� |
�ڱ������ᶡ���¹��� | ������ˮ�����ڶ����л��ܼ� | ���� | 202��210�� |
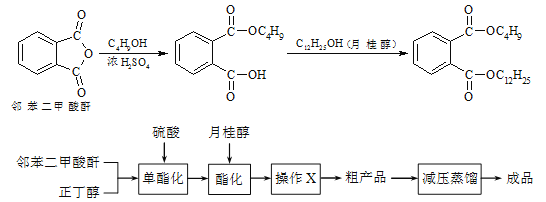
ijʵ��С���ͬѧģ�ҵ�����Ĺ������̣�����ͼ��ʾװ����ȡ�����ڱ������ᶡ���¹�����ͼ�мгֺͼ���װ������ȥ����Ҫ�����������£�
����������ƿ�ڼ���30 g �ڱ�����������16 g �������Լ�����Ũ���ᡣ
�����裬������105 �����������跴Ӧ1Сʱ��
����ȴ�����£�����40 g �¹�������160 �������衢��������Ӧ������
����ȴ�����£�����Ӧ����ﵹ����
��ͨ�����������еIJ���X���õ��ֲ�Ʒ��
��ش��������⣺
��1������C������___________������������ˮӦ��___________����
��2����������жϷ�Ӧ�ѽ����ķ�����___________��
��3��������в���X�ɳ�ȥ����δ��Ӧ���ڱ�����������������������X����___________��
��4�����������м�ѹ�����Ŀ����___________��
��5��ʵ������������ڡ��۲��ʶ��Ƚϸߣ�ԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2�����ش��������⣺
��1��B2A4������Bԭ�ӹ�����ӻ�����Ϊ ��B2A4�����ЦҼ��ͦм�������Ϊ ��
��2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ______________����Ԫ�ط��ű�ʾ����������CA3�ķе�Ȼ�����BA4�ĸߣ�����Ҫԭ���� ��
��3��Ԫ��B��һ����������Ԫ��C��һ�������ﻥΪ�ȵ����壬Ԫ��C������������ķ���ʽ�� ��
��4��Ԫ��E���γɶ��������磺E(CO)5�ȡ�
�ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ ��
��E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������� ��������ͣ����þ�����E�Ļ��ϼ�Ϊ ��
��5��E��C�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ����Ļ�ѧʽΪ_______�������������Eԭ�Ӽ�ľ���Ϊacm����þ�����ܶ���______g��mL-1��
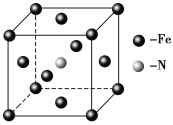
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ú�DZ���Ļ�ʯȼ�ϣ����ǽ�úֱ����Ϊȼ��̫�˷ѣ�����ͨ��ú��______��ý�̿��ú���ͺͳ�¯ú���Ȳ�Ʒ��ú��������ָ��ú�ڸ�������ˮ�Ӵ�ת��Ϊ����Ϊ��ҵ������ȼ���Լ������ϳ�ԭ�ϵ�ú������д��ú�������Ļ�ѧ��Ӧ����ʽ:_________________��
��2����A1��Fe2O3��ɵ����ȼ���ַ�Ӧ��Ĺ���ֳ����ȷݣ�һ����������NaOH��Һ��Ӧ���ɱ����6.72�������壬��һ����������HCl��Һ��Ӧ���ɱ����17.92���������������ȷ�Ӧ�ķ���ʽΪ____________________��ԭ���ȼ�����Ϊ______�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
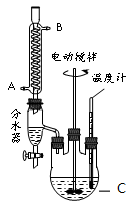
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�131.4�����۵�9.79����������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2���������������з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����
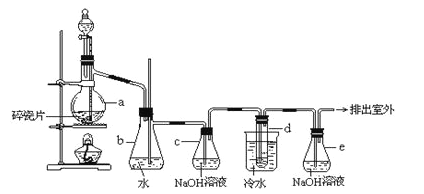
����д���пհף�
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�������Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170������������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ��
��2��д���Ʊ�1��2����������Ļ�ѧ����ʽ�� ��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е����� ��
��4������c��NaOH��Һ�������ǣ� ��
��5���жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ�A��B��C��D��E��FΪԪ�����ڱ�ǰ�����ڵ�Ԫ�أ�ԭ��������������AԪ�صĵ����ǿ�������Ҫ�ɷ֣�Bԭ�Ӻ���p�������1�ԳɶԵ��ӣ�DԪ�صļ۵������������������һ�룬C��Bͬ���壬A��Fͬ���壬D��Eͬ�塣�ش��������⣺
��1��A��B��C��һ�������ɴ�С��˳��Ϊ�� ����Ԫ�ط��ű�ʾ����
��2��B��C�γɵĶ�Ԫ�������У����ڷǼ��Է��ӵ��ǣ� ���ѧʽ�����÷�������ԭ�ӵ��ӻ�����Ϊ�� ��
��3��A��CԪ���γɵij����������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ4������ �����ѧʽ����ͬ�������ƽ�������ε����� ��
��4��E��F�γɵ�һ�ֻ�����ľ���ṹ��ͼ��ʾ����û�����Ļ�ѧʽΪ ��F����λ��Ϊ ��
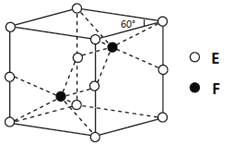
��5��D�����ӿ����γɶ���������Dn+��Br-��C��
��ۺ��������A�ļ��⻯���γɵ�1:1:1:5��ij
���������������Һ�еμ�AgNO3��Һ����
����ɫ�������μ�BaCl2��Һ��������������Ļ�ѧʽΪ�� ��nֵΪ ��Dn+�Ļ�̬�����Ų�ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҳ��ü���װ��ģ����ʾ��ҵ����ԭ����ʵ��װ��ͼ��ʵ�鲽�����£�
![]()
![]()
![]()
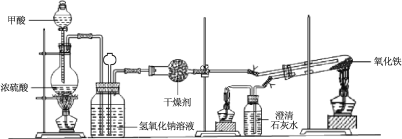
�� ����ͼ���Ӻ�װ�ã����װ�������ԡ�
�� ��ȡ���� Fe2O3��ʯӢ�Թ��У���ȼ�����ƾ��ƣ�����������ᡣ
�� �����ij�������ȼ���������ƾ��ơ�
�� 30 min��Ϩ��ƾ��ƣ��رյ��ɼС�
�� ��������ȴ�����º��ռ����
�� �������Ϸ����ֱ��ռ����������־ƾ��ƣ��������ֿ��Լ��л��桢����¶ȣ��;ƾ���Ƽ��ȵIJ��
��ش��������⣺
��1���Ʊ�CO��ԭ�������ü��ᣨHCOOH����Ũ������������µķֽ��Ƶã�ʢ�ż������������Ϊ ���÷�Ӧ�Ļ�ѧ����ʽ ��
��2��ʵ�鲽����ij�������ָ ��
��3��ʵ�鲽����Ϩ��ƾ��Ƶ�˳��Ϊ______________������I��II��III��
��4��ͨ�������ϻ�ȡ������Ϣ��
I���ƾ���ƽ���¶�Ϊ600���������־ƾ���ƽ���¶�Ϊ700�����ƾ����ƽ���¶�Ϊ930����
II������ָ������Ӧ�¶ȸ���710����Fe���ȶ����ڣ�680����710��֮�䣬FeO�ȶ����ڣ�����680��������Ҫ��Fe3O4���Է����ƾ��Ƽ�������������Fe��ԭ���� ��
��5����֪FeO��Fe2O3��Fe3O4��Ԫ�ص����������ֱ�Ϊ��22.2%��30%��27.6%�����������������3����Ʒ����Ԫ�������Ԫ�ص������������±���
���ȷ�ʽ | ����Ԫ����� | ��Ԫ�ص���������%[��������] | |
Fe | O | ||
�ƾ��� | Fe��O | 74.50 | 25.50 |
�����־ƾ��� | Fe��O | 76.48 | 23.52 |
�ƾ���� | Fe | 100.00 | 0.00 |
������Ԫ�ص�����������֪ǰ���ּ��ȷ�ʽ�õ��IJ���Ϊ�������оƾ��Ƽ������ò������������_______�ֿ��ܡ�
��6��ͨ����һ���������������ǰ���ּ��ȷ�ʽ�õ��Ĺ����ĩ�ɷ־�ΪFe3O4��Fe���þƾ���Ƽ��ȵõ��Ĺ����ĩ�ɷ�ΪFe����������þƾ��Ƽ��ȷ�ʽ�������Fe3O4��Fe��������Ϊ_____����Ҫ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������A������ת����ϵ��
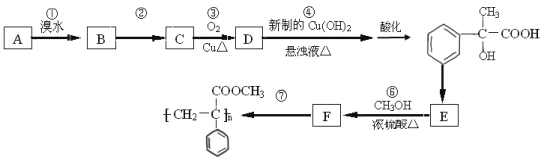
��1��д����Ӧ�ں͢ݵķ�Ӧ�������� ���� .
��2��д��A�Ľṹ��ʽ�� ��
��3��д����Ӧ�ܵĻ�ѧ����ʽ�� .
��4����Ӧ�۵ķ�Ӧ���� .
��5��������ѧ֪ʶ�ͻ�ȡ����Ϣ��д����CH3COOH,![]() Ϊԭ�Ϻϳ���Ҫ�Ļ�����Ʒ
Ϊԭ�Ϻϳ���Ҫ�Ļ�����Ʒ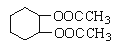 ��·������ͼ�����Լ���ѡ��
��·������ͼ�����Լ���ѡ��
�ϳ�·������ͼʾ�����£�
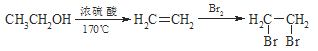
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com