
【题目】![]() 已知:
已知:![]()
![]() ;
;![]() ,根据上述信息,写出C转化为CO的热化学方程式_________________________________________。
,根据上述信息,写出C转化为CO的热化学方程式_________________________________________。
![]() 已知热化学方程式:
已知热化学方程式:![]()
![]() ,该反应的活化能为
,该反应的活化能为![]() ,则其逆反应的活化能为___________
,则其逆反应的活化能为___________![]()
![]() 用
用![]() 催化还原
催化还原![]() 可以消除氮氧化物的污染。例如:
可以消除氮氧化物的污染。例如:
![]()
![]()
![]()
![]()
若用标准状况下![]() 还原
还原![]() 生成
生成![]() ,反应中转移的电子总数为_______
,反应中转移的电子总数为_______![]() 用阿伏加德罗常数
用阿伏加德罗常数![]() 表示
表示![]() ,放出的热量为_______kJ。
,放出的热量为_______kJ。
![]() 已知
已知![]() ;
;![]() 。蒸发1mol
。蒸发1mol![]() 需要吸收的能量为30J,其它相关数据如下表,则表中 a为__________________
需要吸收的能量为30J,其它相关数据如下表,则表中 a为__________________
|
|
|
|
1mol分子中的化学键断裂时 需要吸收的能量 | 436 | a | 369 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素周期表、元素周期律及其相关应用叙述正确的是( )
A.原子的种类和元素的种类一样多
B.在现行元素周期表中,所含元素种数最多的是ⅢB族
C.可以在元素周期表金属与非金属分界处寻找催化剂
D.IA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的中心原子的杂化杂化类型为__。基态P原子核外电子占据最高能级的电子云轮廓图为__。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸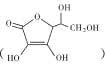 常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
(3)Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是___(填标号)。
A.![]() B.
B. C.
C.![]() D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。
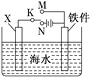
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是
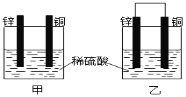
A.装置甲中铜片表面产生气泡
B.装置甲溶液中SO42ˉ向锌片做定向移动
C.装置乙中正极的电极反应式:2H++2eˉ=H2↑
D.装置乙中电子从铜片经导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com