
【题目】请回答下列问题:
(1)根据题意选择以下四种物质的字母序号填空
A:Si B:Na2SiO3 C:Ca(ClO)2 D:KAl(SO4)2·12H2O
①漂白粉的有效成分是___。
②可用于制备硅胶和木材防火剂的是___。
③可用于制计算机芯片的是___。
④可用于作净水剂的是___。
(2)8.4gNaHCO3正好与20mL盐酸完全反应。此盐酸的物质的量浓度是___,产生的CO2在标准状况下的体积是___L。
(3)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①请用“单线桥”标明该反应电子转移的方向与数目___。
②该反应中氧化剂是___;当有1molNa2FeO4生成,转移的电子有___mol。
【答案】C B A D 5mol/L 2.24 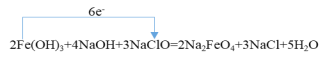 NaClO 3
NaClO 3
【解析】
(1).物质的化学性质或物理性质会决定物质相应的用途,解答此题需要识记物质相应的性质。
(2).已知NaHCO3的质量,可求得其物质的量,又NaHCO3与20mL盐酸完全反应了,再根据碳酸氢钠与盐酸反应方程式解答此题。
(3).由制取高铁酸钠反应方程式可知此反应为氧化还原过程,其中Fe(OH)3为还原剂在反应中Fe失去电子化合价升高。NaClO为氧化剂,Cl得到电子。
(1).①漂白粉的有效成分为Ca(ClO)2,通过反应产生次氯酸,从而使漂白粉具备杀菌消毒作用,答案选C。
②硅胶是一种硅酸凝胶,可由Na2SiO3加酸制取,同时Na2SiO3不燃不爆性质稳定,可作为防火剂,答案选B。
③Si属于半导体材料,计算芯片由硅晶圆制得,答案选A。
④KAl(SO4)2·12H2O溶于水,其中Al3+可水解生成氢氧化铝胶体,氢氧化铝胶体吸附水中杂质而聚沉,从而起到净水作用,答案选D。
(2).根据分析,先计算出n(NaHCO3) =8.4g/(23+1+12+48)g.mol-1 =0.1mol,NaHCO3 + HCl = NaCl + CO2 ↑+H2O此过程完全反应,则由该方程计算得n(HCl) =0.1mol,从而c(HCl) =0.1mol/0.02L =5mol/L。产生n(CO2) =0.1mol,标况下得V(CO2) =0.1mol ×22.4L/mol =2.24L。故答案为5mol/L,2.24。
(3).①根据分析,电子转移方向为Fe(OH)3→ NaClO,转移6e-。答案为 。
。
②由分析可知,氧化剂为NaClO,反应过程Fe的化合价+3→+6,则生成1molNa2FeO4转移电子数为3mol。答案为NaClO,3。


科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
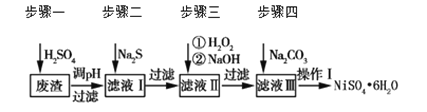
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_______(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式________。
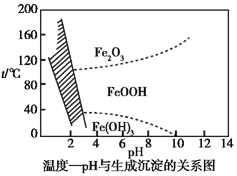
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠![]() (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl![]() +6H+
+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_______。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是_______。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;
②___________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,工作一段时间后,在两极区均得到副产品NH4NO3。下列叙述错误的是( )
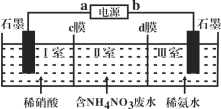
A.a极为电源负极,b极为电源正极
B.c膜是阳离子交换膜,d膜是阴离子交换膜
C.阳极电极反应式为4OH--4e-=O2↑+2H2O
D.Ⅱ室溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的中心原子的杂化杂化类型为__。基态P原子核外电子占据最高能级的电子云轮廓图为__。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸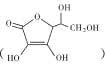 常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
常被用作碳包覆的碳源,其易溶于水的原因是___,1mol抗坏血酸中手性碳原子的数目为___。
(3)Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是___(填标号)。
A.![]() B.
B. C.
C.![]() D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列有机化合物:
A. B.
B. 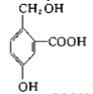 C.
C. 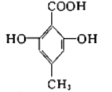 D.
D.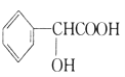 E.CH2=CHCOOCH=CHCOOCH=CH2
E.CH2=CHCOOCH=CHCOOCH=CH2
(1)可以看作醇类的是__________(填字母,下同)。
(2)可以看作酚类的是__________。
(3)可以看作羧酸类的是__________。
(4)可以看作酯类的是__________。
(5)有机物A中含有的官能团有_________种(填数字)。
(6)有机物C中含有的官能团有__________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为__________________。
(2)利用如图装置,可以模拟铁的电化学防护。
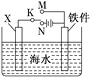
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________________处。
②若X为锌,开关K置于M处,该电化学防护法称为__________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量____3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是______________________,若将开关K置于N处,发生的总反应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是
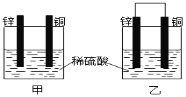
A.装置甲中铜片表面产生气泡
B.装置甲溶液中SO42ˉ向锌片做定向移动
C.装置乙中正极的电极反应式:2H++2eˉ=H2↑
D.装置乙中电子从铜片经导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )

A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com