
【题目】室温下,往0.001mol·L-1的氨水中滴入几滴酚酞试液时,溶液呈现粉红色。现采取下列措施,其中能使滴有酚酞的氨水溶液颜色变浅的是
A.往溶液中滴入0.2mol·L-1的氨水
B.往溶液中加入NH4Cl晶体
C.往溶液中加入CH3COONa固体
D.往溶液中加入NaOH固体
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C 为短周期元素,它们的位置关系如图所示,已知 B、C 两元素原子核内质子数之和是 A 元素的原子核内质子数的 4 倍。

(1)写出 A、B 的元素符号:A____、B____。
(2)B 在周期表中的位置为____,C 的离子结构示意图为____。
(3)A 的氢化物的分子式为____;B、C 的最高价氧化物对应的水化物的分子式分别为____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)短周期中可以做半导体材料的元素的最高价氧化物与烧碱溶液反应的离子方程式是:__________;
(2)为了提高煤的利用率,常将其气化或液化,其中一种液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇,写出该化学反应方程式为____________;
(3)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是________反应(填“吸热”或“放热”)。
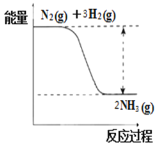
②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
(4)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
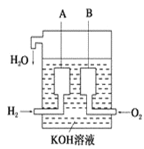
A,B两个电极均由多孔的碳块组成。该电池的正极反应式为:________________;若将上述装置中的氢气换成甲烷,其余都不改变,对应装置的负极反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇![]() 制备环己烯.已知:
制备环己烯.已知:
密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5mL环已醇加入试管A中,再加入1ml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品。
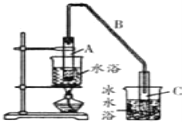
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______。
②写出环已醇制备环已烯的化学反应方程式___________________________。
③试管C置于冰水浴中的目的是____________________________。
(2)环已烯粗品中含有环已醇和少量酸性杂质等需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在_______层(填上或下),分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是_____________________________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环已烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l) ![]() C10H12(l)+3H2(g) △H1②C10H12(l)
C10H12(l)+3H2(g) △H1②C10H12(l)![]() C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
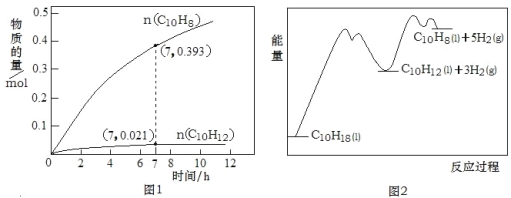
下列判断正确的是( )
A. 反应至7h时,C10H18的转化率为2.1%
B. 在7h时,反应体系中氢气的物质的量为0.849mol
C. 反应①的活化能高于反应②的活化能
D. △H2>△H1>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验),请回答下列问题:
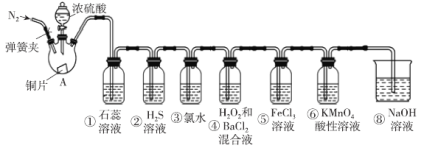
(1)在A中发生反应的化学方程式为___。
(2)①中的实验现象为紫色石蕊溶液___。
②中的实验现象为___,写出此化学反应方程式___。
③中的实验现象是___,写出此化学反应方程式___。
④中的实验现象是___,写出此化学反应方程式___。
⑤中的现象是溶液由黄色变为浅绿色,其反应的离子方程式为___。
(3)能体现出SO2还原性的实验序号是___。
(4)实验结束后需要通入N2,其目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象、结论及其推理都正确的是 ( )
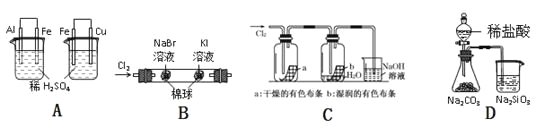
实验 | 实验现象 | 结论 |
A | 左烧杯中铁不断溶解,右烧杯中铁表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | a中布条不褪色,b中布条褪色 | 干燥氯气无漂白性,潮湿的氯气有漂泊性 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
② 1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是_______________________。
(aq)的热化学方程式是_______________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4) 已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1 ②
O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________。
(5) 已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炽热的炉膛内有反应:![]() 往炉膛内通入水蒸气时,有如下反应:
往炉膛内通入水蒸气时,有如下反应:![]() ,
,![]() ,
,![]() ,其能量变化示意图如下,
,其能量变化示意图如下,

已知CO的燃烧热为![]() 。下列有关说法正确的是
。下列有关说法正确的是![]()
A.![]()
B.![]() 的燃烧热为
的燃烧热为![]()
C.在反应![]() 中,反应物总键能大于生成物总键能
中,反应物总键能大于生成物总键能
D.往炽热的炉膛内通入水蒸气可节省燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com