
【题目】十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l) ![]() C10H12(l)+3H2(g) △H1②C10H12(l)
C10H12(l)+3H2(g) △H1②C10H12(l)![]() C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
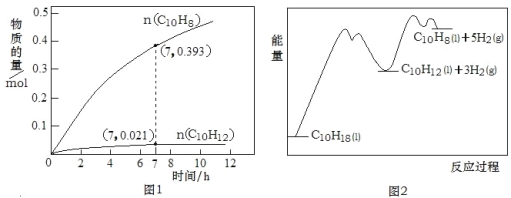
下列判断正确的是( )
A. 反应至7h时,C10H18的转化率为2.1%
B. 在7h时,反应体系中氢气的物质的量为0.849mol
C. 反应①的活化能高于反应②的活化能
D. △H2>△H1>0
【答案】C
【解析】
A. 反应至7h时,根据反应②C10H8的产量为0.393mol,C10H12消耗0.393mol,7h时C10H12剩余0.021mol,即反应①中共生产C10H12为0.393mol+0.021mol=0.414 mol,即消耗C10H18为0.414 mol,所以C10H18的转化率为0.414 mol/1.000molⅹ100%=41.4%,A错误;
B. 在7h时,n(C10H8)=0.393mol,n(C10H12)=0.021mol,则反应生成的氢气的量为:n(H2)=3×(C10H8+C10H12)+2×C10H8=3×(0.393mol+0.021mol)+2×0.393mol =2.028mol,B错误;
C. 根据图1,反应①的曲线变化慢,反应②的曲线变化快,说明催化剂降低了反应②的活化能,结合图2的反应进程与能量的关系,可得反应①的活化能高于反应②的活化能,C正确。
D.根据图2显示,反应物的总能量低于生成物的总能量,反应①和反应②均为吸热反应,相同时间内,产生C10H8的物质的量更大,说明生成C10H8的反应更易进行,所以△H1>△H2即△H1>△H2>0。D错误。
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
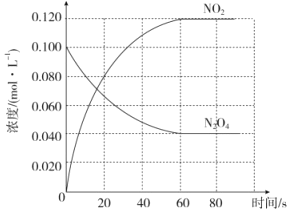
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,10s又达到平衡。T_______100℃(填“大于”“小于”)。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动
(4)再次到达平衡后,向容器中加入合适的正催化剂,则v正_______v逆_______,(填“增大”、“减小”或“不变”),体系的颜色_______(填“变深” “变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
原子半径 | 电负性 | 熔点 | 沸点 |
Al_____Si | N____O | 金刚石_____晶体硅 | CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
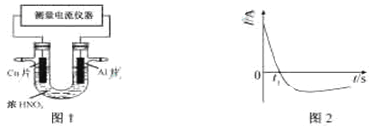
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某兴趣小组的探究性实验图示,有关说法合理的是( )
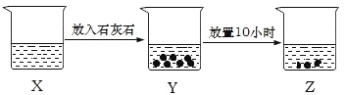
A. 若X中溶液为FeCl2溶液,则Z中最终可生成Fe(OH)2沉淀
B. 若X中溶液为新制的饱和氯水,则烧杯中液体的漂白性:X>Y>Z
C. 若X中溶液为NH4Cl溶液,则烧杯中液体的pH:X>Z
D. 若X中溶液为AlCl3溶液,可通过丁达尔现象证明 Z 中是否存在Al(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.1mol·L-1NH3·H2O溶液、0.1mol·L-1NH4Cl溶液以及H2O的pH随温度的变化曲线如图所示。下列说法正确的是( )
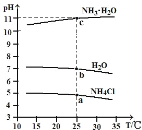
A. 随温度升高,H2O逐渐由弱碱性转变为酸性
B. 25℃时,NH3·H2O的电离常数 Kb≈10-5
C. 水的离子积常数:a点>b点>c点
D. NH3·H2O溶液和NH4Cl溶液pH随温度变化趋势不同,是因为平衡移动方向不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。常 温时下列有关说法中正确的是
A. FeS的溶解度大于CuS的溶解度
B. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯气与过氧化钠在加热条件下的反应,在网上有三种不同的观点:
①氯气和过氧化钠均为强氧化剂,两者不反应。
②能反应,氯气是氧化剂。
③能反应,过氧化钠是氧化剂。为鉴别上述观点的真伪,进行了如下探究实验:

回答下列问题:
(1)过氧化钠的电子式为________,甲装置中发生反应的离子反应方程式为___。
(2)仪器戊的名称为___,其作用为___。
(3)为完成上述实验目的,仪器口连接顺序为a__。如果缺少丙装置, 乙装置中发生的反应为____。
(4)实验结束后,为验证观点②是否正确,需进一步进行的实验操作为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
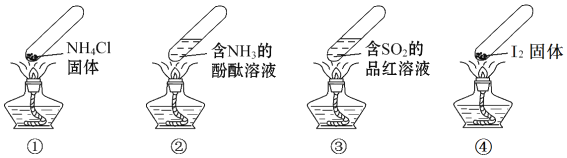
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是___;C元素在元素周期表中的位置是___;甲的电子式是___。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是___;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈___(填“酸”或“碱”)性,用电离方程式表示其原因是___。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试是___。
②A、C组成的化合物中,化学式为C2A6,该物质与D的单质发生反应的类型___,写出其中一个化学方程式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com