
【题目】如图是某兴趣小组的探究性实验图示,有关说法合理的是( )
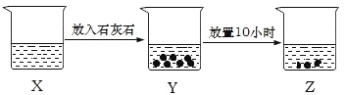
A. 若X中溶液为FeCl2溶液,则Z中最终可生成Fe(OH)2沉淀
B. 若X中溶液为新制的饱和氯水,则烧杯中液体的漂白性:X>Y>Z
C. 若X中溶液为NH4Cl溶液,则烧杯中液体的pH:X>Z
D. 若X中溶液为AlCl3溶液,可通过丁达尔现象证明 Z 中是否存在Al(OH)3胶体
【答案】D
【解析】
石灰石(CaCO3)加入,根据沉淀溶解平衡和弱电解质的电离平衡有:CaCO3(s) ![]() Ca2+(aq)+CO32-(aq),CO32-+H+
Ca2+(aq)+CO32-(aq),CO32-+H+![]() HCO3-,因此可以调节溶液的pH。
HCO3-,因此可以调节溶液的pH。
A. 若X中溶液为FeCl2溶液,FeCl2是强酸弱碱盐,Fe2+发生水解,生成Fe(OH)2白色沉淀,Fe(OH)2在空气中易被氧气氧化,则Z中最终可生成Fe(OH)3沉淀,A错误;
B. Cl2+H2O![]() H++Cl-+HClO,碳酸钙使平衡正向移动。Y中HC1O的浓度最大,z中HClO的浓度最小,所以三只烧杯液体的漂白性: Y> X> Z,故B错误;
H++Cl-+HClO,碳酸钙使平衡正向移动。Y中HC1O的浓度最大,z中HClO的浓度最小,所以三只烧杯液体的漂白性: Y> X> Z,故B错误;
C. 若X中溶液为NH4Cl溶液,X中溶液呈酸性,加入石灰石后与溶液中H+反应,溶液碱性增强,则烧杯中液体的pH:X<Z,C错误;
D. 若X中溶液为AlCl3溶液,铝离子水解形成Al(OH)3,Z 中是否存在Al(OH)3胶体,可以通过丁达尔现象证明,D正确;
答案选D。


科目:高中化学 来源: 题型:
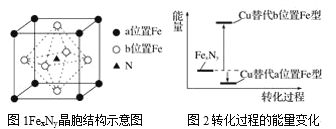
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为___。
(2)丙酮(CH3CCH3O)分子中碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___。
(3)C、H、O三种元素的电负性由小到大的顺序为____。
(4)乙醇的沸点高于丙酮,这是因为______。
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为____。
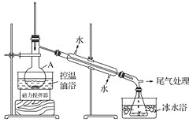
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·cm-3。实验室制备少量1溴丙烷的主要步骤如下:步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20 mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1溴丙烷。
(1)仪器A的名称是___;加入搅拌磁子的目的是搅拌和___。
(2)反应时生成的主要有机副产物有2溴丙烷和____。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_____。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是___。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12 mL5%Na2CO3溶液,振荡,___,静置,分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
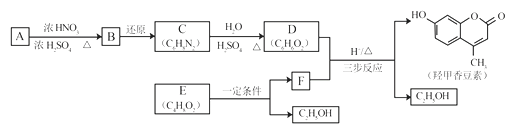
【题目】羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:
已知: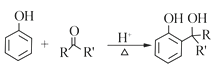
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是__________________。B中所含的官能团是_____________。
(2)C→D的反应类型是___________________。
(3)E属于酯类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:
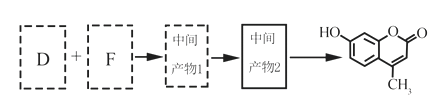 D:______________、F:______________、中间产物1:______________、中间产物2:______________
D:______________、F:______________、中间产物1:______________、中间产物2:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
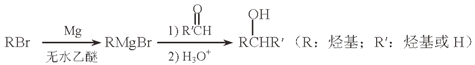
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示,请回答下列问题:
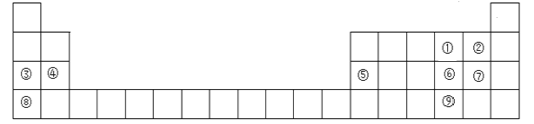
(1)元素⑨在周期表中的位置是_______。
(2)元素①~⑨中,非金属性最强的元素是_______(填元素符号)。
(3)元素①~⑨中,最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),它与元素⑤的最高价氧化物对应水化物反应的离子方程式为_______。
(4)元素⑨的简单氢化物与元素⑦的简单氢化物中更稳定的是_______(填化学式)。
(5)元素③与元素①形成的淡黄色化合物的电子式为_______。
(6)元素①的简单氢化物比元素⑥的简单氢化物的沸点_______(填“高”或“低”),原因是_______。
(7)元素④与元素⑦形成的化合物是_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向恒容密闭容器中充入1molN2与4molH2,发生化学反应N2(g)+3H2(g)![]() 2NH3(g),当反应达到最大限度时,下列说法正确的是( )
2NH3(g),当反应达到最大限度时,下列说法正确的是( )
A.V(N2)=V(NH3)
B.单位时间内,断裂1molN![]() N,同时断裂2molN-H
N,同时断裂2molN-H
C.此时,容器内气体的平均摩尔质量不再变化
D.此时,该反应不一定达到了化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l) ![]() C10H12(l)+3H2(g) △H1②C10H12(l)
C10H12(l)+3H2(g) △H1②C10H12(l)![]() C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
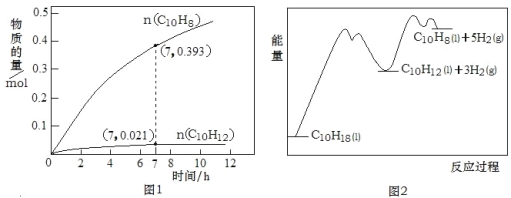
下列判断正确的是( )
A. 反应至7h时,C10H18的转化率为2.1%
B. 在7h时,反应体系中氢气的物质的量为0.849mol
C. 反应①的活化能高于反应②的活化能
D. △H2>△H1>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是
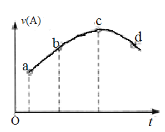
A. 反应物A的浓度:a点小于b点
B. A的平均反应速率:ab段大于bc段
C. 曲线上的c、d两点都表示达到平衡状态
D. 该反应的生成物可能对反应起催化作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com