
【题目】在一定条件下,向恒容密闭容器中充入1molN2与4molH2,发生化学反应N2(g)+3H2(g)![]() 2NH3(g),当反应达到最大限度时,下列说法正确的是( )
2NH3(g),当反应达到最大限度时,下列说法正确的是( )
A.V(N2)=V(NH3)
B.单位时间内,断裂1molN![]() N,同时断裂2molN-H
N,同时断裂2molN-H
C.此时,容器内气体的平均摩尔质量不再变化
D.此时,该反应不一定达到了化学平衡状态
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.碳酸钠溶液中逐滴加入等物质的量的乙酸 CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
B.二氧化硫通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO
C.用碳棒作电极电解氯化钠饱和溶液 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.碳酸钡溶于氢氟酸 BaCO3+2H+=Ba2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图所示的转化关系,请回答下列问题:

(1)A中官能团的名称为___,B中官能团的电子式为__。
(2)在F的同系物中最简单的有机物的空间构型为__。
(3)写出与F互为同系物的含5个碳原子的有机物的所有同分异构体中,其中一氯代物种类最少的同分异构体的结构简式:___。
(4)写出下列编号对应反应的化学方程式,并注明反应类型:
②___,___;
④___,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某兴趣小组的探究性实验图示,有关说法合理的是( )
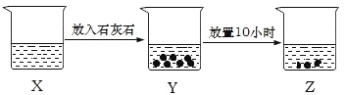
A. 若X中溶液为FeCl2溶液,则Z中最终可生成Fe(OH)2沉淀
B. 若X中溶液为新制的饱和氯水,则烧杯中液体的漂白性:X>Y>Z
C. 若X中溶液为NH4Cl溶液,则烧杯中液体的pH:X>Z
D. 若X中溶液为AlCl3溶液,可通过丁达尔现象证明 Z 中是否存在Al(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如图:

根据以上材料和你所学的化学知识,回答下列问题:
(1)乙烯的结构简式为___,官能团的名称是___。
(2)乙烯是重要的工业原料,下列有关乙烯叙述不正确的是(__________)
A.常温常压下是气体
B.能使溴的四氯化碳溶液褪色
C.可使酸性高锰酸钾溶液发生加成反应而褪色
D.在氧气中燃烧有明亮的火焰
(3)除去甲烷中的乙烯所用的试剂是___(填序号)。
A.稀硫酸 B.溴水 C.水 D.酸性高锰酸钾溶液
(4)反应①的化学方程式是___,反应类型是____。
(5)反应④的化学方程式是___,反应类型是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。常 温时下列有关说法中正确的是
A. FeS的溶解度大于CuS的溶解度
B. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-a kJ·mol-1(a>0)。下列说法不正确的是
3Z(g) △H=-a kJ·mol-1(a>0)。下列说法不正确的是
A. 达到化学平衡状态时,反应放出的总热量可能达到akJ
B. 升高反应温度,逆反应速率增大,正反应速率减小
C. 达到化学平衡状态时,X、Y、Z的浓度不再发生变化
D. 0.1 mol X和0.2 molY充分反应生成Z的物质的量一定小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
c(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
①前10分钟内的平均速率v(NO)=___________________mol·L-1·min-1
②下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内气体的密度不变时,说明反应已达平衡
D.若该反应的平衡常数K值变大,在平衡移动过程中正反应速率先增大后减小
(2)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。
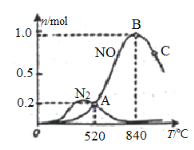
已知:反应I 4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0
4NO(g) +6H2O(g) △H<0
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g) △H<0
2N2(g) +6H2O(g) △H<0
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
②反应I的活化能Ea(正)________ Ea(逆) (填“小于”“等于”或“大于”)。
③520℃时,4NH3(g)+5O2![]() 4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(3)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为________________________________________。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com