
【题目】实验测得0.1mol·L-1NH3·H2O溶液、0.1mol·L-1NH4Cl溶液以及H2O的pH随温度的变化曲线如图所示。下列说法正确的是( )
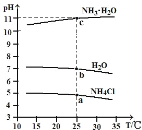
A. 随温度升高,H2O逐渐由弱碱性转变为酸性
B. 25℃时,NH3·H2O的电离常数 Kb≈10-5
C. 水的离子积常数:a点>b点>c点
D. NH3·H2O溶液和NH4Cl溶液pH随温度变化趋势不同,是因为平衡移动方向不同
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)![]() 2C(g) H <0,下列错误的是( )
2C(g) H <0,下列错误的是( )
A. 升高温度,v(正)、v(逆)都增大,但v(逆)增加的程度更大
B. 增大压强,v(正)、v(逆)都增大,但v(正)增加的程度更大
C. 增大A的浓度,v(正)会增大,但v(逆)会减小
D. 使用催化剂,一般v(正)、v(逆)同时增大,而且增大的倍数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示,请回答下列问题:
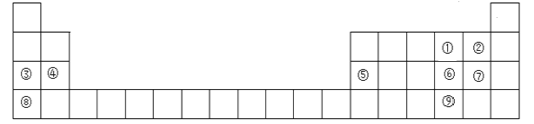
(1)元素⑨在周期表中的位置是_______。
(2)元素①~⑨中,非金属性最强的元素是_______(填元素符号)。
(3)元素①~⑨中,最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),它与元素⑤的最高价氧化物对应水化物反应的离子方程式为_______。
(4)元素⑨的简单氢化物与元素⑦的简单氢化物中更稳定的是_______(填化学式)。
(5)元素③与元素①形成的淡黄色化合物的电子式为_______。
(6)元素①的简单氢化物比元素⑥的简单氢化物的沸点_______(填“高”或“低”),原因是_______。
(7)元素④与元素⑦形成的化合物是_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(s)+3B(g)![]() 2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
A.2min末,气体D在标准状况下的体积无法计算
B.用物质B、C、D来分别表示该反应的速率之比为3:2:1
C.由于A为纯固体,物质的量浓度是常数,故无法利用A的相关物理量的变化来表示该反应的速率大小
D.单位时间内,每消耗0.3molB气体,同时消耗0.1molD气体,此时该反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l) ![]() C10H12(l)+3H2(g) △H1②C10H12(l)
C10H12(l)+3H2(g) △H1②C10H12(l)![]() C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
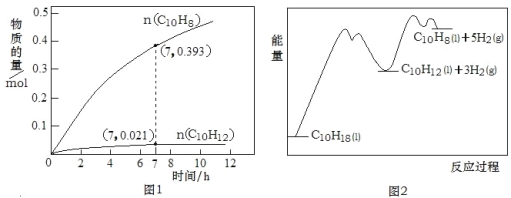
下列判断正确的是( )
A. 反应至7h时,C10H18的转化率为2.1%
B. 在7h时,反应体系中氢气的物质的量为0.849mol
C. 反应①的活化能高于反应②的活化能
D. △H2>△H1>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)![]() CH3OH(g) △H1=﹣99kJ·mol-1
CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=﹣41kJ·mol-1
CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_____。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是____(填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是___(填标号)。
a.气体平均相对分子质量保持不变
b.△H3保持不变
c.![]() 保持不变
保持不变
d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3 的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为___(用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,![]() 只与温度有关。15min时,=___(结果保留2位小数)。
只与温度有关。15min时,=___(结果保留2位小数)。
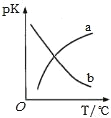
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线___(填“a”或“b”)能反映平衡常数变化趋势。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 足量H2使0.1molCuO还原为Cu时转移的电子数为0.2NA
B. 32gS8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 2g由H218O和2H2O组成的混合物中含有的质子数为NA
D. 标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些有机化合物的模型如图所示。回答下列问题:
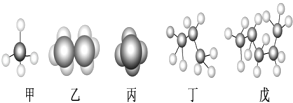
(1)属于比例模型的是___(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是___。
(3)存在同分异构体的是___,写出其同分异构体的结构简式___。
(4)含碳量最低的是___,含氢量最低的分子中氢元素的质量百分含量是___(保留一位小数)。
(5)C8H10属于苯的同系物的所有同分异构体共有___种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com