
【题目】对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)![]() 2C(g) H <0,下列错误的是( )
2C(g) H <0,下列错误的是( )
A. 升高温度,v(正)、v(逆)都增大,但v(逆)增加的程度更大
B. 增大压强,v(正)、v(逆)都增大,但v(正)增加的程度更大
C. 增大A的浓度,v(正)会增大,但v(逆)会减小
D. 使用催化剂,一般v(正)、v(逆)同时增大,而且增大的倍数相同
【答案】C
【解析】
A、升高温度化学反应速率加快,反应向着吸热方向进行;
B、增大压强化学反应速率加快,反应向着气体的系数和减小的方向进行;
C、增大物质的浓度反应速率加快,反应向消耗该物质的方向进行;
D、使用催化剂可同时、同等程度的改变正逆反应速率;
A、升高温度v(正)、v(逆)都增大,同时反应向着逆方向进行,v(逆)增加的程度更大,A正确;
B、增大压强v(正)、v(逆)都增大,同时反应向着正方向进行,v(正)增加的程度更大,B正确;
C、增大A的浓度v(正)、v(逆)都会增大,同时反应向着正方向进行,v(正)增加的程度更大,C错误;
D、使用催化剂可同时、同等程度的改变正逆反应速率,所以采用正的催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同,D正确;
正确选项C。


科目:高中化学 来源: 题型:
【题目】如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是
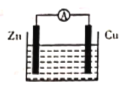
A. 锌做负极发生氧化反应
B. 供电时的总反应为Zn+2H+=Zn2++H2↑
C. 该装置可实现化学能转化为电能
D. 正极产生1 mol H2,消耗锌的质量为32.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个3L的真空密闭容器中(预先装入催化剂)通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强是起始时的0.9倍。在此时间段内v(H2)为0.1 mol·L-1·min-1,则经过的时间为( )
A. 2 min B. 3 min C. 4 min D. 6 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是()

A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
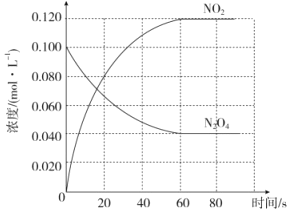
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________molL-1s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020molL-1s-1的平均速率降低,10s又达到平衡。T_______100℃(填“大于”“小于”)。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动
(4)再次到达平衡后,向容器中加入合适的正催化剂,则v正_______v逆_______,(填“增大”、“减小”或“不变”),体系的颜色_______(填“变深” “变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
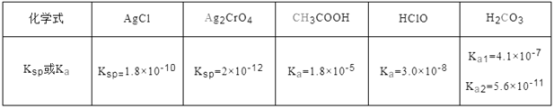
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2===2HCO3-+Cl-+ClO-
C. 向0.1 mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol· L-1的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.1mol·L-1NH3·H2O溶液、0.1mol·L-1NH4Cl溶液以及H2O的pH随温度的变化曲线如图所示。下列说法正确的是( )
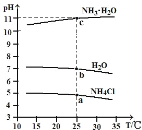
A. 随温度升高,H2O逐渐由弱碱性转变为酸性
B. 25℃时,NH3·H2O的电离常数 Kb≈10-5
C. 水的离子积常数:a点>b点>c点
D. NH3·H2O溶液和NH4Cl溶液pH随温度变化趋势不同,是因为平衡移动方向不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com