
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
【答案】D
【解析】
A.中和热是酸碱发生中和反应产生1mol液态水时放出的热量;表示中和热的热化学方程式为NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.4kJ·mol-1, A错误;
B.该反应是可逆反应,不能进行到底,所以在容器中充入2molSO2 和1molO 2 反应物不能完全反应,最终放出的热量小于196.64kJ,B错误;
C.燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量;水在气态时不稳定,只有生成液态水时稳定,C错误;
D.石墨转化为金刚石为吸热,说明石墨能量低,金刚石能量高,石墨比金刚石稳定,D正确;正确选项D。


科目:高中化学 来源: 题型:
【题目】将二氧化碳转化为乙烯的装置如图,使用的电极材料均为惰性电极。下列正确的是( )
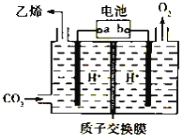
A. a为电源的正极B. 每生成0.1mol乙烯,同时生成6.72LO2
C. 电解过程中,阳极区c(H+)逐渐减小D. 阴极反应为:2CO2+12H++12e- = C2H4+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
选项 | A | B | C | D |
实验 装置 |
|
|
|
|
实验 目的 | 制取少量纯净的CO2气体 | 验证钠和水的反应是放热反应 | 制取并收集干燥纯净的NH3 | 进行喷泉实验 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
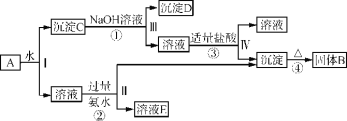
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是____
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B___;沉淀D______;溶液E____。
(3)写出①③反应的化学方程式,离子反应写离子方程式。
①______。
③______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜、铁和硫酸铜溶液组成的原电池中,作正极的是_______________(填化学式),正极的电极反应式为____________________________;作负极的是____________________(填化学式),电子由___________________(填“正”或“负”,下同)极经导线移向________________极,总反应的离子方程式为_________________________。若以反应![]() 来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。
来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室制备溴苯的一种装置图如图所示:
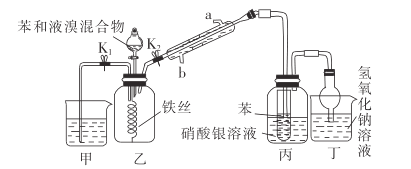
(1)盛装苯和液溴混合物的仪器名称是___________,冷凝水应从_____________(填“a”或“b”)口进入;实验开始时,打开________________(填“![]() ”或“
”或“![]() ”,下同),关闭_________________。
”,下同),关闭_________________。
(2)乙装置中发生反应的化学方程式为________________________________。
(3)丁装置中球形干燥管的作用是_____________________________。
(4)丙装置中的现象是________________________________。
(5)若实验时,实验室无液溴,但有溴水,则如何操作才能继续让该实验做成功?_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
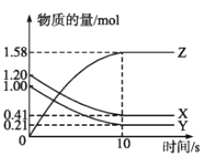
(1)写出该反应的化学方程式_________________________。
(2)计算反应开始到10s,用X表示的反应速率是___________。
(3)下列叙述中能说明上述反应达到平衡状态的是_________。
a.当X与Y的反应速率之比为1:1
b.混合气体中X的浓度保持不变
c.X、Y、Z的浓度之比为1:1:2
(4)为使该反应的反应速率增大,可采取的措施是_______。
a.适当降低温度 b.扩大容器的体积 c.充入一定量Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对恒温恒容密闭容器中的可逆反应:A(g)+3B(g)![]() 2C(g) H <0,下列错误的是( )
2C(g) H <0,下列错误的是( )
A. 升高温度,v(正)、v(逆)都增大,但v(逆)增加的程度更大
B. 增大压强,v(正)、v(逆)都增大,但v(正)增加的程度更大
C. 增大A的浓度,v(正)会增大,但v(逆)会减小
D. 使用催化剂,一般v(正)、v(逆)同时增大,而且增大的倍数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2===4ClO2↑+H++Cl-+2H2O。(HClO2为弱酸)向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应缓慢,随后反应迅速加快,其原因是
A. 溶液中的Cl-起催化作用 B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物浓度降低 D. 在酸性条件下,亚氯酸钠的氧化性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com