
【题目】将二氧化碳转化为乙烯的装置如图,使用的电极材料均为惰性电极。下列正确的是( )
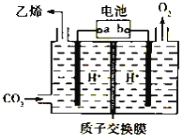
A. a为电源的正极B. 每生成0.1mol乙烯,同时生成6.72LO2
C. 电解过程中,阳极区c(H+)逐渐减小D. 阴极反应为:2CO2+12H++12e- = C2H4+4H2O
【答案】D
【解析】
电解强酸性的二氧化碳水溶液得到乙烯,二氧化碳得电子生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,为还原反应,a为电池的负极,则b为电池的正极,阳极上氢氧根失电子放出氧气,据此分析解答。
A.由二氧化碳得电子生成乙烯,发生还原反应,所以a为电池的负极,故A错误;
B.阴极二氧化碳得电子生成乙烯,阳极氢氧根失电子放出氧气,总反应为:2CO2+2H2O=C2H4+3O2,每生成0.1mol乙烯,同时生成0.3molO2,但温度压强不知,不能计算生成氧气的体积,故B错误;
C.阳极氢氧根失电子放出氧气,阳极区c(H+)增大,故C错误;
D.由二氧化碳得电子生成乙烯,发生还原反应,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 澄清石灰水与过量碳酸氢钠溶液反应:![]() +Ca2++OH﹣=CaCO3↓+H2O
+Ca2++OH﹣=CaCO3↓+H2O
B. 硫酸氢钠溶液中加入氢氧化钡溶液至中性:H++![]() +Ba2++OH﹣=BaSO4↓+2H2O
+Ba2++OH﹣=BaSO4↓+2H2O
C. 向氢氧化钠溶液中通入足量CO2:2OH﹣+CO2=![]() +H2O
+H2O
D. 向氢氧化钡溶液中加入过量硫酸:2H++![]() +Ba2++2OH﹣=BaSO4↓+2H2O
+Ba2++2OH﹣=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.4.0g金属钙变成钙离子时失去的电子数为0.1NA
B.46gNO2和N2O4的混合气体含有的原子数为3NA
C.3.01×1023个氮分子中含有的原子数为2NA
D.0.1molOH-中含有的电子数为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现白蚁信息素有:A. ![]() ; B.
; B. ![]() ;家蚕的信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试回答下列问题:
;家蚕的信息素为:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。试回答下列问题:
(1)下列说法正确的是________(填序号)。
A.信息素A、B互为同系物
B.以上三种信息素均能使溴的四氯化碳溶液褪色
C.信息素A、B互为同分异构体
D.1mod家蚕信息素与1molBr2加成产物只有一种
(2)用系统命名法命名:信息素A的名称为___________________;信息素B与氢气加成产物的名称为_____________________________。
(3)烯烃C是信息素A的一种同分异构体,C与足量氢气加成得到烷烃D,D的一氯代物只有2种,则D的结构简式为_________________________________。
(4)写出信息素B与溴水发生反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是
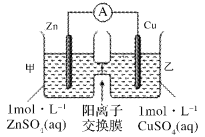
A. 该装置中电子的流动方向为:铜电极→锌电极
B. 电池工作一段时间后,甲池溶液的总质量不变
C. 电池工作一段时间后,乙池的c(SO42-)不变
D. 溶液中阳离子通过交换膜从负极区向正极区移动保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,基态原子电子排布式为____。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有__。
(3)Sm(钐)的单质与l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
则lmol CH2=CH2中含有的σ键数目为___。(用NA表示阿伏伽德罗常数的值)
(4)与N3-互为等电子体的分子有___(写其中一个的化学式即可)。
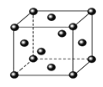
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。Ce(铈)原子的配位数为___,列式表示Ce(铈)单质的密度:___g/cm3(用NA表示阿伏伽德罗常数的值,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
则:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能够增大此反应中NO的转化率的是___(填字母序号)
a.增大容器的体积 b.降低温度 c.增大CO的浓度 d.增大NO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min内,以NO表示的该反应速率υ(NO)=__________,该条件下的平衡常数K=___________(保留2位小数)。
②第15min后,温度调整到T2,数据变化如上表所示,则T1___________T2(填“>”、“<”或“=”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol·L-1)时,溶液中c(Ag+)为__mol·L-1,此时溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是
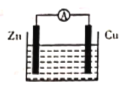
A. 锌做负极发生氧化反应
B. 供电时的总反应为Zn+2H+=Zn2++H2↑
C. 该装置可实现化学能转化为电能
D. 正极产生1 mol H2,消耗锌的质量为32.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com