
【题目】SiC、GaN、GaP、GaAs等是人工合成半导体的材料,具有高温、高频、大功率和抗辐射的应用性能而成为半导体领域研究热点。试回答下列问题:
(1)碳的基态原子L层电子轨道表达式为__,砷属于__区元素。
(2)N与氢元素可形成一种原子个数比为1:1的粒子,其式量为60,经测定该粒子中有一正四面体构型,判断该粒子中存在的化学键__。
A.配位键 B.极性共价键 C.非极性共价键 D.氢键
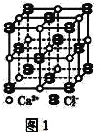
(3)CaC2晶体的晶胞结构与NaCl晶体的相似(如图1所示),但CaC2晶体中含有的哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为__。
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如下图:
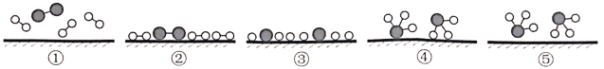
下列说法正确的是____(选填字母)。
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
N2(g)+3H2(g) △H,若N三N键、H一H键和N一H键的键能分别记作a、b和c(单位:kJ·mol-l),则上述反应的△H=___kJ·mol一1。
(3)研究表明金属催化剂可加速氨气的分解。下表为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率(m mol.min一1)。
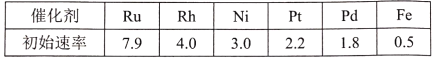
①不同催化剂存在下,氨气分解反应活化能最大的是___(填写催化剂的化学式)。
②温度为T,在一体积固定的密闭容器中加入2 molNH3,此时压强为P0,用Ru催化氨气分解,若平衡时氨气分解的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
N2(g)十3H2(g)用平衡分压代替平衡浓度表示的化学平衡常数Kp=___。[己知:气体分压(p分)=气体总压(p总)x体积分数]
(4)关于合成氨工艺的理解,下列正确的是___。
A.合成氨工业常采用的反应温度为500℃左右,可用勒夏特列原理解释
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产量
C.合成氨工业采用10 MPa一30 MPa,是因常压下N2和H2的转化率不高
D.采用冷水降温的方法可将合成后混合气体中的氨液化
(5)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数[![]() (NH3)]。
(NH3)]。
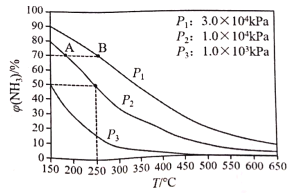
①若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)____vB(NH3)(填“>”、“<”或“=”)。
②在250℃、1.0×104kPa下,H2的转化率为______%(计算结果保留小数点后1位)。
(6)N2和H2在铁作催化剂作用下从145℃就开始反应,随着温度上升,单位时间内NH3产率增大,但温度高于900℃后,单位时间内NH3产率逐渐下降的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在生活及生产中有很多重要用途。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近。已知(CN)2分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为__。(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__。
(2)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮可由NO和O2生成,已知在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g) ΔH, n(NO)、n(O2)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)/mol | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)该反应的化学平衡常数表达式为K=___________________
(2)已知:K800 ℃>K1 000 ℃,则该反应的ΔH_________0(填“大于”或“小于”),
(3)用O2表示0~2 s内该反应的平均速率为_________。
(4)能说明该反应已达到平衡状态的是_________。
a.容器内气体颜色保持不变 b.2υ逆(NO)=υ正(O2)
c.容器内压强保持不变 d.容器内气体密度保持不变
(5)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,应采取的措施有____。
A.升温 B.加入氧气 C. 降温 D.增大压强
(6)在800 ℃时,计算通入2 mol NO和1 mol O2的平衡常数K=_________
(7)已知下列反应在某温度下的平衡常数以及ΔH
H2(g)+S(s) H2S(g) K1 ΔH1
S(s)+O2(g) SO2(g) K2 ΔH2
则在该温度下反应H2(g)+SO2(g) O2(g)+H2S(g) K3 ΔH3
平衡常数K3=__________(用含有K1 K2的式子表示);
其反应热ΔH3=________(用含有ΔH1 ΔH2的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)短周期中可以做半导体材料的元素的最高价氧化物与烧碱溶液反应的离子方程式是:__________;
(2)为了提高煤的利用率,常将其气化或液化,其中一种液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇,写出该化学反应方程式为____________;
(3)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是________反应(填“吸热”或“放热”)。
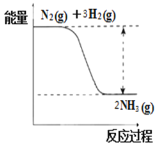
②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
(4)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
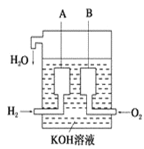
A,B两个电极均由多孔的碳块组成。该电池的正极反应式为:________________;若将上述装置中的氢气换成甲烷,其余都不改变,对应装置的负极反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l) ![]() C10H12(l)+3H2(g) △H1②C10H12(l)
C10H12(l)+3H2(g) △H1②C10H12(l)![]() C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
C10H8(l)+2H2(g) △H2。一定温度下,在1L恒容密闭容器中进行C10H18(1.000mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随时间变化关系如图1所示,上述反应的“能量—反应过程”如图2所示。
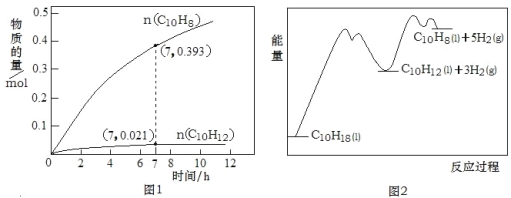
下列判断正确的是( )
A. 反应至7h时,C10H18的转化率为2.1%
B. 在7h时,反应体系中氢气的物质的量为0.849mol
C. 反应①的活化能高于反应②的活化能
D. △H2>△H1>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
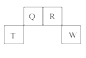
(1)T的原子结构示意图为__,Q元素用于考古学的一种同位素的符号为__,T离子的半径__(填“>”、“<”、“=”)短周期最活泼金属元素的离子半径。
(2)元素Q的最高价氧化物对应水化物的__性(填“酸”、“碱”或“中”)__(填“强于”或“弱于”)W的最高价氧化物对应水化物,故元素的非金属性:Q__W(填“强于”或“弱于”)。
(3)R的氢化物电子式为__,其水溶液呈__性(填“酸”、“碱”或“中”性),实验室常用两种固体共热制取它,其化学方程式为__。
(4)原子序数比R多1的元素的一种氢化物属于四核化合物,该物质属于__(填“离子化合物”、“共价化合物”),用电子式表示其形成过程__。
(5)R有多种氧化物,其中氧化物甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com