
【题目】(多选)在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10﹣13 , 下列说法错误的是( ) 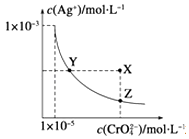
A.t℃时,Ag2CrO4的Ksp为1×10﹣8
B.在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.一定温度下Y点和Z点时Ag2CrO4的Ksp相等
D.在t℃时,Ag2CrO4(s)+2Br﹣(aq)2AgBr(s)+CrO42﹣(aq)平衡常数K=4.0×1010
【答案】AD
【解析】解:A.Ksp(Ag2CrO4)=c(CrO42﹣)c2(Ag+)=(1×10﹣5)×(1×10﹣3)2=1×10﹣11 , 故A错误;B.饱和Ag2CrO4溶液中加入K2CrO4 , c(CrO42﹣)增大,平衡逆向移动,则c(Ag+)减小,而Y点变为X点c(Ag+)不变,不能使溶液由Y点变为X点,故B正确;
C.沉淀溶解平衡曲线上的点均为平衡点,Ksp只与温度有关,则一定温度下Y点和Z点时Ag2CrO4的Ksp相等,故C正确;
D.在t℃时,Ag2CrO4(s)+2Br﹣(aq)2AgBr(s)+CrO42﹣(aq)平衡常数K= ![]() =
= ![]() =
= ![]() =2.0×1014 , 故D错误;
=2.0×1014 , 故D错误;
故选AD.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA)是以有机酸——乳酸为原料生产的新型聚酯材料,性能胜于现有塑料聚乙烯、聚丙烯、聚苯乙烯等材料,是新世纪最具发展前途的新型包装材料,是环保包装材料中的一颗明星。日本钟纺公司以玉米为原料发酵生产聚乳酸,利用聚乳酸制成生物降解性发泡材料。该材料的强度、缓冲性、耐药性等与聚苯乙烯塑料相同,经焚烧后不污染环境,还可肥田。下列说法不正确的是( )
A.聚乳酸使用后能被自然界中微生物完全降解,最终生成二氧化碳和水,不污染环境
B.聚乳酸适用于吹塑、热塑等各种加工方法,加工方便,应用十分广泛
C.聚乳酸(PLA)是一种天然高分子、对环境友好的聚酯材料
D.聚乳酸是以淀粉发酵(或化学合成)得到的,以乳酸为基本原料制备的一种聚酯材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是传统的工业生产金属铝的基本流程图,结合铝生产的流程图解答下列各题:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是(填化学式)。石油炼制和煤的干馏产品(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:(用化学方程式表示)。
(4)工业上制取金属镁时是电解熔融MgCl2 , 电解反应方程式为 , 镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“HI(s) → HI(g) → H2和I2”的变化过程中,被破坏的作用力依次是
A. 分子间作用力、分子间作用力B. 分子间作用力、共价键
C. 共价键、离子键D. 共价键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】防止钢铁的腐蚀是世界级难题,每年全世界钢产量的四分之一因腐蚀而损失
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为、。
(2)为降低某水库的铁闸门的被腐蚀速率,可以采用图甲方案,其中焊接在铁闸门上的固体材料R可以采用________。
A.铜
B.钠
C.锌
D.石墨
(3)图乙所示方案也可降低铁闸门的被腐蚀速率,其中铁闸门应该连接在直流电源的极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相等物质的量的CO和CO2的下列比较中正确的是()
所含的分子数目之比为1:1
所含的氧原子数目之比为1:1
所含的原子总数目之比为2:3
所含的碳原子数目之比为1:1
A. B. C. D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用焦炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物 质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | - | 315 | - |
熔点/℃ | -70.0 | -107.2 | - | - | - |
升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式。
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却的理由是。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成
Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?(填“是”或“否”),请说明理由。
②某同学称取5.000g残留物,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。亚铜离子(Cu+)基态时的价电子排布式表示为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com