
【题目】物质的量相同的铜片分别与体积相同且过量的浓硝酸、稀硝酸反应,下列有关二者的比较相等的是( )
①反应中氧化剂得到的电子总数 ②铜片消耗完所需时间
③反应后溶液中的铜离子浓度(反应前后溶液体积不变) ④反应生成气体的体积(同温、同压)
A.①③B.②④C.①④D.②③
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入等物质的量的A、B,发生如下反应:2A(g)+2B(g) ![]() 3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
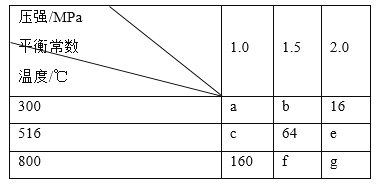
下列判断正确的是( )
A.g>f
B.ΔH<0
C.2.0MPa、800℃时,A的转化率最小
D.1.5MPa、300℃时,B的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是( )
A.硫酸与Na2SiO3溶液混合:SiO![]() +2H+===H2SiO3↓
+2H+===H2SiO3↓
B.Cl2和NaOH溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
C.向亚硫酸氢钠溶液中滴加硫酸氢钠溶液:H++HSO![]() ===SO2↑+H2O
===SO2↑+H2O
D.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
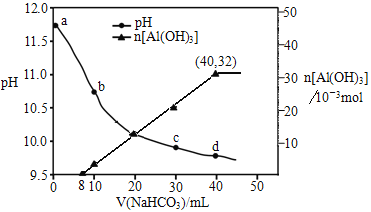
下列有关说法不正确的是
A. NaHCO3溶液的物质的量浓度为0.8 mol/L
B. b点与c点溶液所含微粒种类相同
C. a点溶液中存在的离子是Na+、AlO2-、OH-、H+
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O === Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
① I2(g)+ H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
② I2(s)+ H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的产物比反应②的产物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.28g乙烯与丙烯混合物中含C-H键的数目为4NA
B.标准状况下,22.4L氦气与11.2LH2含有的质子数均为NA
C.1mol Cl2与足量的铁在一定条件下充分反应,转移了3NA电子
D.25℃时,1LpH=11的NaOH溶液与1LpH=11的CH3COONa溶液,含阴离子数均为10-11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组对卤素及其化合物的制备和性质进行如下探究实验,根据实验回答问题。
I.探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应:12FeCl2+3O2![]() 2Fe2O3+8FeCl3,4FeCl2+3O2
2Fe2O3+8FeCl3,4FeCl2+3O2![]() 2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。

(1)实验装置的合理连接顺序为:A→__________→D,装置E的作用是___________。
(2)D中发生反应的离子方程式_______。
(3)某化学兴趣小组在控制在500℃下发生反应,一段时间后的产物进行了如下实验探究:
①对B中反应剩余固体的成分开展实验探究,并作出以下两种假设:
假设一:产物为Fe2O3;
假设二:产物为________(填化学式)。
以下针对上述假设一,展开实验研究,请完善下面表格:
实验操作 | 预期现象与结论 |
取少量固体样品于一支洁净的试管中,加入足量的蒸馏水。 | ______,则假设一成立,否则,假设一不成立。 |
②对固体产物(标准状况下)成分含量进行了如下实验探究:B中反应剩余固体的质量经测定为m1g ,E中生成物的质量经测定为m2g。B中反应剩余固体按探究①的实验步骤进行操作,并最终得到干燥纯净的固体质量为m3g。则固体产物中Fe2O3所占的质量分数为______。
Ⅱ.卤素化合物之间反应实验条件控制探究
(4)室温下,KClO3可将KI氧化为I2或KIO3。下面是该小组设计的一组实验数据记录表:
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1KI溶液/ mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4溶液/ mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
反应完全后,滴加2滴淀粉溶液 | 无色 | 蓝色 | 蓝色较2浅 | 无色 |
①根据实验数据,结合所学化学知识,下列说法正确的是______
A.该实验目的是探究其它条件相同时,酸的浓度对反应产物的影响
B.实验1和实验4说明硫酸浓度太低或太浓,KClO3与KI均不反应
C.实验2的现象说明在该硫酸浓度下KClO3将KI氧化为I2
D.实验3蓝色较2浅的原因是在该硫酸浓度下淀粉部分水解
②2号试管反应完全后,假设还原产物只有KC1,写出反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com