
下列有关化学用语正确的是
①乙烯的最简式C2H4 ②乙醇的结构简式C2H6O
③四氯化碳的电子式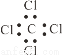 ④乙炔的结构简式CHCH
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3 ⑥乙醛的结构简式CH3COH
A.全对 B.全错 C.③④⑤ D.③④⑥
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:选择题
下列关于阿佛加德 罗常数的说法正确的是
罗常数的说法正确的是
A.0.1 NA的NO在一密闭容器中与足量氧气完全反应,得到0.1 mol NO2
B.一定条件下的密闭容器中,6.4 g SO2可被氧气氧化得到SO3的分子数为0.1 NA
C.常温下18 g铝放入足量浓硫酸中转移电子数2 NA
D.1 L 0.1 mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质分类的说法中,正确的是
A.SiO2不能和水反应,所以它不是酸性氧化物
B.只由一种元素组成的物质必然是纯净物
C.烧碱、冰醋酸、石墨均为电解质
D.海水、氯水、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:实验题
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 molL-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 molL-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 molL-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 molL-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① molL-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | ③ | 生成白色沉淀 |
ii | 向i所得溶液中滴加0.1 molL-1 FeCl3溶液 | ④ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列日常生活中的现象与氧化还原反应无关的是
A.铜铸塑像上出现铜绿[Cu2(0H)2C03]
B.用石膏点豆腐
C.不良商贩用硫黄熏蒸法制作“白豆芽”
D.自来水厂用氯气对水进行消毒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列说法错误的是
A.萃取操作时,选择有机萃取剂,溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:填空题
某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:

(1)流程②的目的是_________________.流程④操作用到的玻璃仪器有烧杯、______________。
H2SeO3与SO2的离子反应方程式为 。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。工业提取Se的流程中,可循环利用的物质是_________________。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL.则电解铜阳极泥中Se的质量分数为____________。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:选择题
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。已知充电时电池总反应为:LiMn2O4=Li1-xMn2O4+xLi,下列叙述正确的是

A.放电时,正极反应为xLi++xe-=xLi
B.放电时,a极锂的化合价不发生变化
C.充电时,b极发生氧化反应
D.充电时,溶液中的Li+从b极向a极迁移
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作中,正确的是
A.过滤时,玻璃棒紧靠一层滤纸的那一边
B.配制一定物质的量浓度溶液时,直接用烧杯向容量瓶加水至刻度线
C.检验某溶液中是否含有钾离子:用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色
D.用自来水制蒸馏水时,加热一段时间后,发现未加沸石,立即打开烧瓶加入几粒沸石
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com