
【题目】下列反应可用离子方程式“H++OH-=H2O”表示的是
A. 稀硫酸与澄清石灰水溶液混合
B. 浓硫酸与烧碱溶液混合
C. 浓硝酸与氢氧化钾溶液混合
D. 浓盐酸与石灰乳溶液混合
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
B.能导电的物质不一定是电解质,电解质不一定能导电
C.碳酸钠和碳酸氢钠分别溶于水中,均放热
D.酸性氧化物不一定是都是非金属氧化物,而非金属氧化物一定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1nm~100nm (1nm=10-9m) 的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过半透膜 ⑥静置后,会析出黑色沉淀。其中正确的是
A. ①④⑥ B. ②③④ C. ②③⑤ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废金属屑中主要成分为Cu和Fe,此外还含有少量![]() ,该厂用上述废金属屑制取新型高效水处理剂
,该厂用上述废金属屑制取新型高效水处理剂![]() (高铁酸钠)等产品,过程如下:
(高铁酸钠)等产品,过程如下:
I. 向废金属屑中加入稀![]() ,充分反应后,剩余两种固体单质和溶液;
,充分反应后,剩余两种固体单质和溶液;
II. 向I所得固体中继续加入足量稀![]() ,过滤后,向所得固体中加入硫酸酸化的
,过滤后,向所得固体中加入硫酸酸化的![]() ,固体溶解得
,固体溶解得![]() 溶液;
溶液;
III. ……
(1)步骤I所得溶液中加入KSCN溶液无明显现象,用离子方程式解释其可能的原因______________________________________。步骤I所得溶液中滴加NaOH溶液,看到的现象是________,涉及的化学反应方程式是_________、_______________。向I所得固、液混合物中通入过量氯气,并不断搅拌,充分反应后,溶液中的金属阳离子是(填写离子符号)____________。
(2)步骤II中![]() 在酸性条件下氧化了铜,获得
在酸性条件下氧化了铜,获得![]() 溶液。参加反应的
溶液。参加反应的![]() 与Cu的物质的量之比为____________。
与Cu的物质的量之比为____________。
(3)步骤I所得溶液经进一步处理可制得![]() ,流程如下:
,流程如下:
![]()
写出由![]() 制取
制取![]() 的离子反应方程式______________________。
的离子反应方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以![]() 形式存在。化学课外小组将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬浊液,然后按以下实验流程提取
形式存在。化学课外小组将海带灼烧成灰,用水浸泡一段时间,得到海带灰悬浊液,然后按以下实验流程提取![]() 单质(已知
单质(已知![]() 可以氧化
可以氧化![]() ):
):
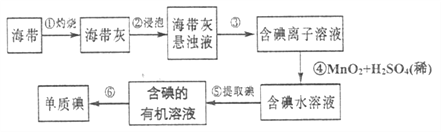
(1)指出制取碘的过程中有关的实验操作名称:③_________⑤__________。
(2)提取碘的过程中,可供选择的有机溶剂是__________(填字母代号)。
A. 酒精 B. ![]() C. 醋酸
C. 醋酸
(3)步骤④中每消耗![]() 转移
转移![]() 电子,生成
电子,生成![]() ,则发生反应的离子方程式为___________。
,则发生反应的离子方程式为___________。
(4)为实现步骤⑤的转化,实验室里有烧杯、玻璃棒、量简以及必要的夹持仪器、物品。尚缺少的玻璃仪器是___________。
(5)多次通过步骤⑤操作,可获取较高浓度的含碘有机溶液。若从中再提取![]() ,可以加入
,可以加入![]() 的
的![]() 溶液,将
溶液,将![]() 转化成可溶于水的含碘化合物:
转化成可溶于水的含碘化合物: ![]() 。经操作I分离得到含碘化合物的水溶液,再向其中加入过量的45%的硫酸溶液,生成
。经操作I分离得到含碘化合物的水溶液,再向其中加入过量的45%的硫酸溶液,生成![]() 沉淀,经操作II获得碘单质。则操作I的名称是_________,操作II的名称是________(填字母)。
沉淀,经操作II获得碘单质。则操作I的名称是_________,操作II的名称是________(填字母)。
A. 过滤 B. 蒸发 C. 蒸馏 D. 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。请回答:
(1)生成的黑色(单质)物质是__________ (填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是___________ (填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为:______________________________________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有__________(填序号)。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(4)将实验(2)产生的刺激性气味气体通入品红溶液,可以看到品红溶液_________ 说明这种气体具有_____________________性;将(2)中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填空.
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9
B.13
C.11~13之间
D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①和两种粒子的物质的量之和等于0.1mol.
②和两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣)
D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 , 上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)c(NH3H2O)(填“>”、“<”、或“=).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于非氧化还原反应的是
A. 3CuS+8HNO3==3Cu(NO3)2+2NO↑+3S↓+4H2O
B. 3Cl2+6KOH==5KCl+KClO3+3H2O
C. 3H2O2+2KCrO2+2KOH==2K2CrO4+4H2O
D. 3CCl4+K2Cr2O7==2CrO2Cl2+2COCl2+2KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com