
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
分析 A.铜与稀硝酸反应生成的是一氧化氮气体;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.硫酸铝与氨水反应生成氢氧化铝沉淀和硫酸铵;
D.氢氧化钠溶液足量,反应生成碳酸钙沉淀、碳酸钠和水,产物中应该存在碳酸根离子.
解答 解:A.将铜插入稀硝酸中生成硝酸铜、NO气体和水,正确的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故A错误;
B.向Fe2(SO4)3溶液中加入过量铁粉,反应生成硫酸亚铁,正确的离子方程式为:2Fe3++Fe=3Fe2+,故B错误;
C.向Al2(SO4)3溶液中加入过量氨水,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C正确;
D.Ca(HCO3)2溶液中加足量NaOH溶液,反应生成碳酸钠、碳酸钙沉淀和水,正确的离子方程式为:2HCO3-+Ca2++2OH-=CO32-+CaCO3↓+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
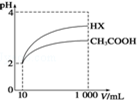 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
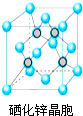 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶中的水垢 | |
| B. | 红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| C. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  观察Fe(OH)2的生成 | B. |  中和滴定 | ||
| C. |  除去CO2气体中的HCl气体 | D. | 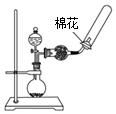 制取并收集干燥的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1 | B. | 0.6mol•L-1 | C. | 1.0mol•L-1 | D. | 1.6mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com