
 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.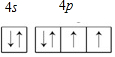 .
.分析 (1)硒为34号元素,有6个价电子,据此书写价层电子排布图;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;同主族,从上到下,元素的第一电离逐渐减小;
(3)根据中心原子的价层电子对数可判断杂化方式及微粒的立体构型,等电子体是指价电子和原子数都相等的微粒;
(4)H2Se分子中有孤电子对,据此判断分子的极性;根据晶体的性质可判断晶体的类型;
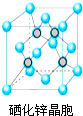
(5)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,该晶胞中含有硒原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有锌原子数为4,根据$ρ=\frac{m}{V}$可计算出晶胞的体积,进而确定晶胞的边长;
解答 解:(1)硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4,价层电子排布图为
故答案为: ;
;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,所以Ge、As、Se三种元素的第一电离能的大小顺序是:As>Se>Ge,
故答案为:As>Se>Ge;
(3)SeO32-的中心原子的价层电子对数为$\frac{6+2}{2}$=4,所以Se杂化方式为sp3杂化,SeO32-的中心原子Se的价层电子对数为$\frac{6+2}{2}$=4,离子中有一个孤电子对,所以SeO32-的立体构型是 三角锥形,等电子体是指价电子和原子数都相等的微粒,与SeO42-互为等电体的分子有CCl4(或SiF4),
故答案为:sp3; 三角锥形;CCl4(或SiF4);
(4)H2Se分子中有孤电子对,所以H2Se属于 极性分子,水分子之间有氢键,所以沸点高低:H2O>H2Se,单质硒的熔点为217℃,比较小,所以它属于分子晶体,
故答案为:极性;>;水分子之间有氢键;分子;
(5)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有锌原子数为4,根据$ρ=\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{V}$,所以V=$\frac{4M}{ρ{N}_{A}}$,则晶胞的边长为$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm=$\root{3}{\frac{4M}{ρ{N}_{A}}}$×1010pm,
故答案为:4;$\root{3}{\frac{4M}{ρ{N}_{A}}}$×1010pm.
点评 本题考查了价电子排布、原子轨道的杂化、等电子体、分子的极性、分子的空间构型、晶胞的计算等知识,注意把握微粒空间构型的判断方法,侧重对学生综合能力的考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠中约含有6.02×1023个氯化钠分子 | |
| B. | 常温常压下,2.24LC2H4中含有共用电子对的数目为0.6NA | |
| C. | 0.1molNa2O2与足量的水反应,转移电子数为0.2NA | |
| D. | 200mL 0.5 mol•L-1的Na2CO3溶液中CO32-离子数目小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、NaCl溶于水,破坏的化学键类型相同 | |
| B. | 某物质中含有离子键,则该物质在任何条件下均可导电 | |
| C. | 干冰是分子晶体,其气化过程中只需克服分子间作用力 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液的方法分离汽油和水的混合物 | |
| B. | 用蒸馏的方法提取碘水中的碘 | |
| C. | 用溶解、过滤的方法提纯含有少量Ba(OH)2的BaSO4 | |
| D. | 用升华的方法除去固体食盐中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的二氧化硅 | |
| D. | 捕获工业排放的CO2能降低地球的温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com