
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:分析 (1)根据v=$\frac{\frac{△n}{V}}{△t}$计算出从反应开始到10s时用Y表示的反应速率为;
(2)根据各物质的物质的量与化学计量数成正比写出该反应方程式;
(3)将其化成同一物质的速率,然后比较其大小.
解答 解:(1)从反应开始到10s时,Y的物质的量变化为:1.00mol-0.21mol=0.79mol,则该段时间内用Y表示的反应速率为:v(Y)=$\frac{\frac{0.79mol}{2L}}{10s}$=0.0395 mol•L-1•s-1,故答案为:0.0395mol•L-1•s-1;
(2)由图象可以看出,反应中X、Y的物质的量减少,应该为反应物,Z的物质的量增多,应为生成物,
当反应进行到10s时,△n(X)=0.79mol、△n(Y)=0.79mol、△n(Z)=1.58mol,则△n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:X(g)+Y(g)?2Z(g),
故答案为:X(g)+Y(g)?2Z(g);
(3)确定A的速率为:甲:v(X)=0.3mol•L-1•s-1;
乙:v(Y)=0.12mol•L-1•s-1,故v(X)=0.12mol•L-1•s-1;
丙:v(Z)=9.6mol•L-1•min-1=$\frac{9.6}{60}$=0.16mol•L-1•s-1,故v(X)=$\frac{1}{2}$×0.16mol•L-1•min-1=0.08mol•L-1•s-1,故最快的是乙,最慢的是丙,故答案为:丙<甲<乙.
点评 本题主要考查化学平衡的变化图象,题目难度不大,可以根据所学知识进行回答,本题要注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>C>D | B. | 单质熔点:D>B,A>C | ||
| C. | 原子半径:C>B>D>A | D. | 简单离子半径:C>A>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阴极质量增加6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | 10g 46%乙醇溶液中含氧原子0.1NA | |
| D. | 苯与液溴反应生成1mol 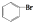 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
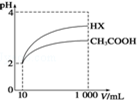 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液使紫色石蕊试液变蓝;结论:溶液一定呈碱性 | |
| B. | 无色溶液焰色反应呈紫色(透过蓝色钴玻璃观察),结论:溶液中一定含有K+ | |
| C. | 在无色溶液中加入Na2CO3溶液产生白色沉淀;结论:溶液中一定含有Ca2+ | |
| D. | 在无色盐溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝;结论:溶液一定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
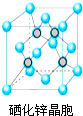 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.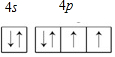 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶中的水垢 | |
| B. | 红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| C. | “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH | B. | 醋酸的电离平衡常数 | ||
| C. | 溶液中醋酸的物质的量浓度 | D. | 醋酸的电离程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com