
| A. | 无色溶液使紫色石蕊试液变蓝;结论:溶液一定呈碱性 | |
| B. | 无色溶液焰色反应呈紫色(透过蓝色钴玻璃观察),结论:溶液中一定含有K+ | |
| C. | 在无色溶液中加入Na2CO3溶液产生白色沉淀;结论:溶液中一定含有Ca2+ | |
| D. | 在无色盐溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝;结论:溶液一定含有NH4+ |
分析 A.紫色石蕊试液遇碱变蓝;
B.透过蓝色钴玻璃观察焰色反应为紫色,可知为K的焰色;
C.加入Na2CO3溶液产生白色沉淀,白色沉淀可能为碳酸钡、碳酸钙等;
D.气体使湿润的红色石蕊试纸变蓝,气体为氨气.
解答 解:A.紫色石蕊试液遇碱变蓝,则由现象可知溶液一定呈碱性,故A正确;
B.透过蓝色钴玻璃观察焰色反应为紫色,可知为K的焰色,则溶液中一定含有K+,故B正确;
C.加入Na2CO3溶液产生白色沉淀,白色沉淀可能为碳酸钡、碳酸钙等,则溶液中不一定含有Ca2+,故C错误;
D.气体使湿润的红色石蕊试纸变蓝,气体为氨气,则溶液一定含有NH4+,故D正确;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象和结论为解答的关键,侧重分析与实验能力的考查,注意离子检验中排除干扰离子,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 反应中有3molH2C2O4被还原,转移6mol电子 | |
| B. | KClO3发生了还原反应 | |
| C. | KClO3的还原性强于CO2的还原性 | |
| D. | ClO2作水处理剂时,利用了其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+的最外层电子排布式为3s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: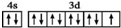 | |
| D. | 基态碳原子的最外层电子排布图: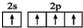 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液的方法分离汽油和水的混合物 | |
| B. | 用蒸馏的方法提取碘水中的碘 | |
| C. | 用溶解、过滤的方法提纯含有少量Ba(OH)2的BaSO4 | |
| D. | 用升华的方法除去固体食盐中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NaAlO2溶液:Al3+、Na+、Cl-、NO3- | |
| B. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、HCO3-、SO42-、CO32- | |
| D. | 0.1 mol•L-1盐酸的澄清透明溶液:Fe3+、K+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
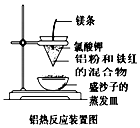 金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.
金属及其化合物渗透在生活中的方方面面,其对我们的生活影响很大.| 检验成分 | 操作步骤 | 实验现象与相关解释或结论 |
| 铝 | 取少量反应后的固体于试管中,加入足量NaOH溶液,振荡 | ①加入NaOH溶液后,固体部分溶解,用化学方程式解释原因Al2O3+2NaOH=2NaAlO2+H2O ②观察到有气泡产生,证明存在Al. |
| 铁红 | ①另取少量反应后的固体于试管中,加入足量稀硫酸, ②(继续填写后续操作)向试管中滴加KSCN溶液 | ①加入硫酸,固体全部溶解, ②现象为溶液变红色,则证明存在铁红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com